时间:2025-06-26 02:16:16
1、选择题 下列事实,不能用勒夏特列原理解释的是
[? ]
A.氯水中有下列平衡:Cl2+H2O HCl+ HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2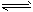 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2 2NH3;△H<0)
2NH3;△H<0)
参考答案:B
本题解析:
本题难度:一般
2、填空题 已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 平衡常数 1.7 1.1 1.0 0.6 0.4 |
参考答案:(1)由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,故答案为:<;
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为0.2mol5L=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
? ?A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04? 0.16? 0? 0
变化(mol/L):x? x? x? x
平衡(mol/L):0.04-x? 0.16-x? x? x
故x2(0.04-x)(0.16-x)=1,解得x=0.032
所以平衡时A的转化率为0.032mol/L0.04mol/L×100%=80%,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
故答案为:0.022;0.09;80%;80%;
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,
?b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,
c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,
d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,
故答案为:c;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为10.4=2.5,
故答案为:2.5.
本题解析:
本题难度:一般
3、选择题 下列事实中,不能用勒夏特列原理解释的是
[? ]
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列事实能用同一原理解释的是
[? ]
A.?SO2和Cl2都能用于漂白?
B. 苯酚、乙烯都能跟溴水反应
C. 苏打、小苏打水溶液的pH都大于7?
D.?I2,?NH4Cl晶体受热都逐渐消失
参考答案:C
本题解析:
本题难度:一般
5、简答题 石油脱硫废气中含有硫化氢,为了有效防止污染,实现废物的综合利用,工业上采用下列工艺过程将硫化氢转化为硫酸和氢气等产品.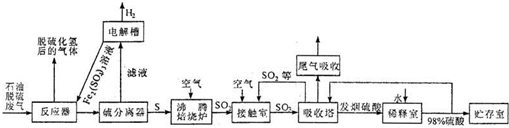
请回答下列问题:
(1)反应器中装有硫酸铁的酸性溶液,该溶液与硫化氢反应的离子方程式是______.
(2)滤液电解后,得到硫酸铁的酸性溶液,再将其返回到反应器中的目的是______.
(3)在实际生产中,二氧化硫转化为三氧化硫的适宜条件是:V2O5作催化剂、常压、400℃~500℃.如图是不同压强下该反应体系中温度与二氧化硫的平衡转化率变化曲线.
考虑工业生产效益并结合图示分析,选择400℃~500℃的原因是______;
选择常压的原因是______.
(4)工业上常用过量氨水吸收尾气中的二氧化硫,该反应的化学方程式是______.
(5)生产过程中,接触室生成的三氧化硫用98%的硫酸吸收,制得一种发烟硫酸(9H2SO4?SO3).某硫酸车间10小时消耗的硫为at,则平均每小时从吸收塔流出的该发烟硫酸为______t(在生产过程中硫的损失忽略不计).
参考答案:(1)在酸性溶液中,具有氧化性的Fe3+与具有还原性的H2S发生氧化还原反应,反应的离子方程式为2Fe3++H2S=2Fe2++2H++S↓,
故答案为:2Fe3++H2S=2Fe2++2H++S↓;
(2)硫酸铁的酸性溶液具有脱硫作用,滤液电解后,得到硫酸铁的酸性溶液可循环使用,
故答案为:使硫酸铁的酸性溶液循环使用;
(3)选择400℃~500℃,反应速率和平衡转化率都较高,如温度过高,转化率反而降低,常压下,平衡转化率较高,如增大压强,会造成设备造价和耗能增加,
故答案为:在此温度下,反应速率和平衡转化率都较高;常压下,平衡转化率较高,且不会因加压造成设备造价和耗能增加;
(4)氨水呈碱性,可与具有酸性的SO2发生化合反应,反应的化学方程式为SO2+2NH3?H2O=(NH4)2SO3+H2O,
故答案为:SO2+2NH3?H2O=(NH4)2SO3+H2O;
(5)98%的硫酸中n(H2SO4):n(H2O)=98g98g/mol:2g18g/mol=9:1,可设浓硫酸的化学式为9SO3?10H2O,
发烟硫酸(9H2SO4?SO3)的化学式变形为10SO3?9H2O,可得反应的关系式:9(9SO3?10H2O)+19SO3=10(10SO3?9H2O),
设10小时生成发烟硫酸的质量为x,
则:9(9SO3?10H2O)+19SO3=10(10SO3?9H2O)
? 19×80? 10×962?
? at32×80? x
x=10×962×at32×8019×80=4810a304t,
所以平均每小时生成发烟硫酸481a304t,
故答案为:481a304.
本题解析:
本题难度:一般