时间:2025-06-26 02:11:24
1、实验题 氯化钠溶液在生产、生活中都有广泛的用途。现配置1?L?0.2?mol/L?NaCl溶液。请回答问题。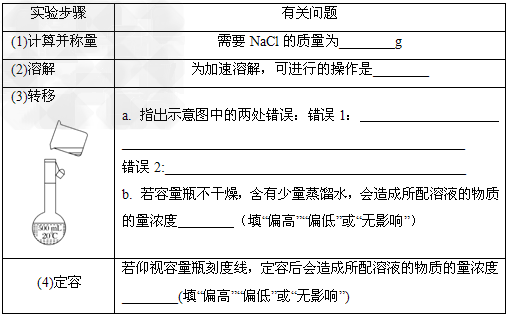
2、选择题 将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
[? ]
A.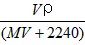
B.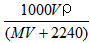
C.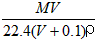
D.100VρM/(MV+2240)
3、填空题 实验室用密度为1.84g/cm3、溶质质量分数为98%的浓硫酸来配制250mL?1.0mol/l?的稀硫酸,
请回答下列问题:
(1)配制250mL?1.0mol/L的硫酸溶液需浓硫酸______ml.
(2)选用的量筒的规格应是______ml.
(3)配制时,其正确的操作顺序是(用字母表示)______.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.先加入少量水(约70mL)倒入烧杯中,用玻璃棒慢慢搅动再用量筒准确量取所需的一定体积的浓硫酸,缓缓倒入烧杯中,并且不断______(填操作名称),使其混合均匀;
C.将已冷却的硫酸沿玻璃棒注入______中,
D.将容量瓶盖紧,振荡,摇匀;
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是______,溶液注入容量瓶前需恢复到室温,这是因为______.
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若加蒸馏水时不慎超过了刻度线______;若定容时俯视刻度线______,若量取浓硫酸时仰视量筒______.
(6)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面______.
4、填空题 在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g?mol-1) 蔗糖 25.00 342 硫酸钾 0.25 174 阿司匹林(C9H8O4) 0.17 180 高锰酸钾 0.25 158 硝酸银 0.02 170 |
5、选择题 与30mL?1mol/L的MgCl2溶液中Cl-浓度相同的是( )
A.150mL?0.2mol/L?FeCl2溶液
B.90mL?2mol/L?NaCl溶液
C.60mL?1mol/LAlCl3溶液
D.30mL?0.5mol/L?CaCl2溶液