时间:2025-06-26 02:10:37
1、选择题 取100mL0.3mol/L硫酸和300mL0.25mol/L的硫酸溶液,混合后稀释到500 mL,则得到的混合溶液中氢离子的物质的量浓度为
A.0.21mol/L
B.0.56mol/L
C.0.42mol/L
D.0.26mol/L
参考答案:C
本题解析:稀释过程中,溶质的物质的量是不变的,所以混合液中氢离子的物质的量浓度是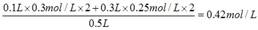 。
。
考点:考查物质的量浓度的计算。
本题难度:一般
2、选择题 对于相同质量的氧气和臭氧,下列说法正确的是( )
A.分子数之比为2:3
B.同温同压下体积之比为3:2
C.标准状况下体积相等
D.标准状况下密度相等
参考答案:相同质量的氧气和臭氧,设质量均为48g,由n=mM可知,氧气、臭氧的物质的量分别为1.5mol、1mol,
A.物质的量之比等于分子数之比,则分子数之比为1.5mol:1mol=3:2,故A错误;
B.同温同压下体积之比,等于物质的量之比,为1.5mol:1mol=3:2,故B正确;
C.由V=nVm可知,标况下,Vm相同,n不等,则V不相同,故C错误;
D.由ρ=mV可知,质量相同,体积不同,则密度不同,故D错误;
故选:B.
本题解析:
本题难度:简单
3、简答题 (1)0.5molCH4的质量是______,在标准状况下的体积为______;含______个氢原子.
(2)将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为______;
(3)配制300mL0.5mol?L-1氯化钠溶液,需要1.5mol?L-1的氯化钠溶液的体积是______mL.
参考答案:(1)0.5mol甲烷的质量=0.5mol×16g/mol=8g,标况下甲烷体积=0.5mol×22.4L/mol=11.2L,每个分子含有4个H原子,故0.5mol甲烷含有氢原子数目=0.5mol×4×NAmol-1=2NA,
故答案为:8g;11.2L;2NA;
(2)HCl的物质的量=22.4L22.4L/mol=1mol,溶于水配成200mL溶液,所得溶液物质的量浓度=1mol0.2L=5mol/L,
故答案为:5mol/L;
(3)令需要1.5mol?L-1的氯化钠溶液的体积是xL,根据稀释定律:0.3L×0.5mol?L-1=x L×1.5mol?L-1,解得x=0.1L,即需要100mL 1.5mol?L-1的氯化钠溶液,
故答案为:100.
本题解析:
本题难度:一般
4、选择题 用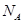 表示阿佛加德罗常数,下列说法正确的是(? )
表示阿佛加德罗常数,下列说法正确的是(? )
A.标准状态下22.4LS03分子数为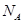
B.7.8gNa202含有的阴离子数是0.2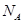
C.常温常压下,l6g02和16g03中所含原子数均为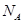
D.1L2mol·L-1的Al(NO3)3溶液中含Al3+个数为2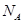
参考答案:C
本题解析:A错误,标准状态下的三氧化硫是非气体状态,不能使用气体摩尔体积计算。
B错误,Na202是由钠离子和过氧根离子构成的离子化合物体,7.8gNa202物质的量为0.1mol,阴离子物质的量为0.1mol,阴离子数是0.1NA。
C正确,质量相同的氧气和臭氧,氧原子数相同,因为都是由氧原子构成的单质。
D错误,铝离子要水解,所以理论计算出1L2mol·L-1的Al(NO3)3溶液含Al3+个数为2NA,但在考虑水解因素的情况下,实际数目是少于2NA。正确选项为C。
本题难度:一般
5、选择题 下列物质中含原子个数最多是( )
A.0.4molO2
B.11.2LCO2(标准状况下)
C.4.5gH2O
D.23gNa
参考答案:A.n(O)=0.4mol×2=0.8mol;
B.n(CO2)=11.2L22.4L/mol=0.5mol,n(原子)=0.5mol×3=1.5mol;
C.n(H2O)=4.5g18g/mol=0.25mol,n(原子)=0.25mol×3=0.75mol;
D.n(Na)=23g23g/mol=1mol,
显然B中原子的物质的量最大,原子个数最多,
故选B.
本题解析:
本题难度:一般