时间:2025-06-26 02:10:37
1、选择题 下列叙述正确的是
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g/mol
C.1 g H2和1 g N2所含分子数相等
D.阿伏伽德罗常数个钠原子的质量是23g
参考答案:D
本题解析:A错,摩尔质量的单位为g/mol;B错,质量的单位是g;C错,1 g H2和1 g N2的物质的量不相等即所含分子数不相等;D正确,阿伏加德罗常数个钠原子的物质的量为1mol,即质量为23g。
本题难度:简单
2、实验题 (12分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。配制时还欠缺的仪器是 。
(2)经计算,需浓H2SO4的体积为 mL(精确到0.1)。
(3)配制过程有以下操作:
A.移液
B.量取
C.洗涤
D.定容
E.溶解
F.摇匀
其正确的操作顺序应是 (填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)= 。
(6)某研究小组欲利用氯气和二氧化硫通入水溶液中来制备100mL含0.4molH+的溶液,反应原理:Cl2+SO2+2H2O= H2SO4+2HCl,若忽略制备过程中气体的损耗,请问需标准状况下的氯气 L。
参考答案:(1)(2分,每空1分)②④ ⑦ 胶头滴管
(2)(2分)5.4mL (3)(2分) B E A C A D F (4)(2分) ①②⑤
(5)(2分)0.1mol/L (6)(2分)2.24
本题解析: (1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、容量瓶,不需要的仪器是烧瓶、托盘天平和药匙,所以答案为②④ ⑦,配制时还缺少胶头滴管。(2)设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=500mL×0.2mol?L-1×98g/mol,解得V=5.4ml。(3)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,所以操作顺序为B E A C A D F。(4)①洗涤量取浓H2SO4后的量筒,不需要将洗涤液转移到容量瓶中,否则实验结果偏高;②稀释后的H2SO4溶液应冷却至室温才能转移到容量瓶,否则冷却后容量瓶中溶液体积减少,浓度偏高;③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,这样会导致溶液的体积偏大,结果偏低④转移前,容量瓶中含有少量蒸馏水,对实验无影响⑤定容时,俯视标线,会使溶液的体积偏小,结果偏高。(5)取出溶液稀释了100/25=4倍,则浓度为原来的1/4,即0.2×2/4=0.1molL;(6)制备100mL含0.4molH+的溶液,由方程式可以知道每消耗1mol的氯气可以生成4mol的氢离子,故需要0.1mol氯气,即在标准状况下2.24L氯气。
考点:考查溶液的配制、误差分析。
本题难度:一般
3、选择题 关于2mol二氧化碳的叙述中,正确的是 ( )
A.质量为44g
B.常温常压下的体积为44.8L
C.分子数为1.204×1024
D.含有4mol氧
参考答案:C
本题解析:A错,质量为88克;B错,标准状况下的体积为44.8L;C正确;D错,含有4mol氧原子;
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温下,39g某浓度的乙炔的苯溶液中总原子数为6NA
B.1mol苯乙烯中含有的碳碳双键数为4NA个
C.标准状况下,11.2L的CHCl3含有的分子多于0.5NA个
D.0.1molCnH2n+2中含有的碳碳单键数为0.1nNA
参考答案:AC
本题解析:乙炔和苯的最简式都是CH,所以常温下,39g某浓度的乙炔的苯溶液中总原子的物质的量是39g÷13g/mol=3mol,A正确。苯中不存在碳碳双键,B不正确;标准状况下,三氯甲烷液态,所以11.2L三氯甲烷的物质的量一定大于0.5mol,C正确;D不正确,根据烷烃的结构特点可知,0.1molCnH2n+2中含有的碳碳单键数为(0.1n-0.1)NA,所以正确的答案选AC。
点评:阿伏加德罗常数是历年高考的“热点”问题。多年来全国高考化学试题重现率几乎为100%。考查阿伏加德罗常数的应用的题目,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
5、填空题 (4分)(1)12.4gNa2X中含0.4mol Na+,则Na2X的摩尔质量是 。
(2)将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸。所需浓硫酸的体积为 。
参考答案:(4分) (1)62g/mol (2)108.7mL (每空2分)
本题解析:(1)盐电离方程式是Na2X=2Na++X2-,可见1mol的盐电离会产生2mol的Na+。现在Na+的物质的量是0.4mol,则盐的物质的量是0.2mol.n=m/M,所以M=m/n=12.4g÷0.2mol=62g/mol;(2)溶液在稀释前后溶质的物质的量不变。在稀释前溶质的物质的量浓度是C=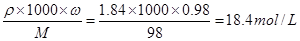 ,由于C1? V1=c2?V2;所以V1= c2?V2/ C1=(1000ml× 2mol/L) ÷18.4mol/L=108.7mL.
,由于C1? V1=c2?V2;所以V1= c2?V2/ C1=(1000ml× 2mol/L) ÷18.4mol/L=108.7mL.
考点:考查物质的量的有关计算的知识。
本题难度:一般