时间:2025-06-26 02:07:16
1、选择题 体积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  ?2SO3(g),ΔH<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
?2SO3(g),ΔH<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
A.图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
参考答案:B
本题解析:A:在增大O2的浓度的瞬间,逆反应速率不变;B正确;C:催化剂不会影响平衡的移动;D:该反应为放热反应,升高温度,左向移动,反应物转化率减小,故乙的温度较高。故答案为B
本题难度:一般
2、实验题 (16分)(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当____ ,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
参考答案:(1)①硫酸(1分), < (1分)
②5H2C2O4 + 2MnO4- + 6H+=10CO2↑ + 2Mn2+ + 8H2O (3分,不配平或配平错扣1分)
(2)②酸式 (2分);反应中生成的Mn2+具有催化作用,所以随后褪色会加快 (2分);滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成浅紫红色,且半分钟不变化。(2分)
③20.00mL(2分); 90.00% (2分)④ACD (2分) (漏写一个得1分)
本题解析:(1)①高锰酸钾具有强氧化性,要酸化高锰酸钾溶液需要选用无还原性的酸,一般选稀硫酸,温度越高反应速率越快,则褪色时间越短,所以褪色所需时间tA<tB;
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水,发生的离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(2)②酸性溶液只能盛放在酸式滴定管中,所以酸性高锰酸钾溶液应该盛放在酸式滴定管中,高锰酸根离子被还原生成的锰离子有催化作用而导致反应速率加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到终点;
③第三次消耗体积与第一次和第二次相差较大,所以要舍去,则消耗KMnO4溶液的平均体积=(20.10?0.00+20.90?1.00)÷2mL=20.00mL,设样品的纯度为x,
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
450g 2mol
5.0x×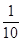 g (0.1×0.020)mol
g (0.1×0.020)mol
x= 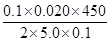 ×100%=90.00%;
×100%=90.00%;
A.酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故正确;B.锥形瓶内有水,对实验无影响,故错误;C.定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故正确;D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,会导致测定高锰酸钾体积偏大,测定值偏大,故正确;E.观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故错误;故选ACD。
考点:考点探究物质的组成及其含量的测定的实验方案设计与评价
本题难度:困难
3、选择题 将mg块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将mg粉末状碳酸钙与同浓度足量盐酸反应,则相应的曲线(图中虚线所示)正确的是(?)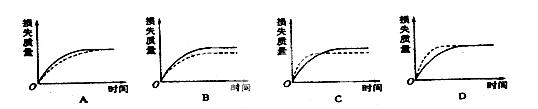
参考答案:D
本题解析:粉末状碳酸钙与盐酸的接触面积更大,反应速率更快,所以质量损失也更快,故虚线应该在实线上面,由于两次实验的碳酸钙质量与盐酸浓度质量都一样,故最终的质量损失一样,实线与虚线叠合在一起,故选D
点评:对该知识点的考查较为偏,属于易错题。需注意接触面积也会影响化学反应速率,但不影响平衡的移动。
本题难度:简单
4、选择题 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得不同时间(t)内产生气体体积(V)的数据如图,根据图示分析实验条件,下列说法中一定不正确的是(?)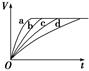
| 组合 | 对应曲线 | c(HCl)/mol·L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | ? | 30 | 粉末状 |
| 2 | b | ? | 30 | 粉末状 |
| 3 | c | 2.5 | ? | 块状 |
| 4 | d | 2.5 | 30 | 块状 |
参考答案:C
本题解析:由图象可知,反应速率:a>b>c>d,D正确。第1、2两组中反应温度相同,铁的状态相同,前者速率大于后者,说明前者盐酸浓度大。第2、4两组中由于铁的状态不同,所以无法判断盐酸的浓度大小,若前者盐酸的浓度是2.5 mol·L-1,则速率也是前者快,A、B可能正确。第3、4两组中盐酸浓度相同,铁的状态相同,而v(c)>v(d),说明第3组中反应温度比第4组高,C错误。
本题难度:一般
5、填空题 下列图象在t1时所对应的反应条件改变可能为: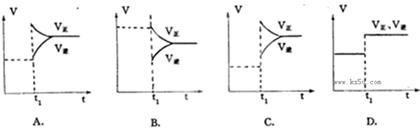
(1)升高温度 ,(2)使用催化剂 ,
(3)增大反应物浓度 ,(4)减少生成物浓度 。
参考答案:(1) C (2) D (3)A (4)B
本题解析:(1)升高温度,瞬间V正、V逆都增大,若正反应为放热反应,V正增大较少、V逆增大较多,
V正<V逆,平衡向逆反应移动,若正反应为吸热反应反应,V正增大较多、V逆增大较少,V正>V逆,平
衡向正反应移动,图象C符合V正增大较多、V逆增大较少,V正>V逆,平衡向正反应移动,正反应为
吸热反应,故答案为:C;(2)使用催化剂,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,
图象D符合,注意若反应前后气体的物质的量不变的反应,增大压强图象也符合,故答案为:D;(3)
增大反应物浓度,瞬间V正增大,V逆不变,V正>V逆,平衡向正反应移动,图象A符合,故答案
为:A;(4)减少反应物浓度,瞬间V正不变,V逆降低,V正>V逆,平衡向正反应移动,图象B
符合,故答案为:B。
考点:化学反应速率与化学平衡图象的综合应用;化学平衡的影响因素
本题难度:一般