时间:2025-06-26 02:04:02
1、选择题 已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。请你据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
2、选择题 下列描述中不符合化学科学的是
A.“曾青得铁则化为铜”中的“曾青”是指硫酸铜
B.“雨后彩虹”和“海市蜃楼”既是自然现象,又是光学现象,也与胶体的知识有关
C.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂
D.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
3、选择题 下列物质的体积最大的是
A.标况下,0.3mol的NH3
B.4℃时,18克水
C.2mol的Al (密度为2.7g/cm3 )
D.100g 37% (密度1.20g/cm3 )NaCl 溶液
4、选择题 需加入适当的氧化剂才能实现的反应是( )
A PCl5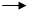 PCl3 B. MnO2
PCl3 B. MnO2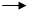 Mn2+
Mn2+
C.SO2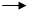 SO32- D. Fe
SO32- D. Fe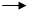 Fe3O4
Fe3O4
5、选择题 下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
A.K+、Ca2+、F-、NO3-
B.K+、Ba2+、Br-、NO3-
C.Na+、K+、CO32-、HCO3-
D.Na+、Ag+、NH3·H2O、NO3-