时间:2025-06-26 02:01:35
1、填空题 (9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
2、选择题 铅蓄电池的工作原理为:Pb+ PbO2 +2H2SO4 = 2PbSO4 + 2H2O研读下图,下列判断不正确的是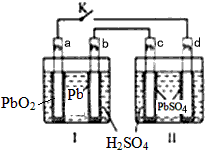
[? ]
A.K 闭合时,d电极反应式:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
3、选择题 关于甲、乙装置的下列叙述中正确的是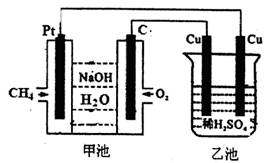
A.甲池中通甲烷的极是负极,溶液中Na+向Pt电极移动
B.C电极的电极反应为:O2+4e-+4H+==2H2O
C.乙池中的总反应为:Cu+H2SO4 H2
H2 +CuSO4
+CuSO4
D.反应过程中,甲、乙装置中溶液的pH都逐渐减小
4、选择题 按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量。下列叙述正确的是
[? ]
A.F表示反应生成Cu的物质的量
B.E表示反应消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
5、填空题 (6分)如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装稀硫酸,B槽中盛装CuSO4溶液。通电一段时间后,发现d电极上覆盖一层红色物质。
根据以上实验事实,回答下列问题:
(1)c极的电极反应式为 ??;
(2)A槽中发生反应的化学方程式为??;
(3)A槽中溶液的pH?(填“变大”、“变小”或“不变”)。
(4)B槽中溶液的pH?(填“变大”、“变小”或“不变”)。