时间:2025-06-26 02:00:45
1、选择题 下列实验操作中错误的是?(?)
A.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取时,溶剂要互不相溶,溶质在两种溶剂中的溶解度相差很大
参考答案:A
本题解析:略
本题难度:简单
2、实验题 (12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用_______(填编号,下同)
① Cl2? ② KMnO4? ③ HNO3? ④ H2O2
(2)要得到较纯的产品,试剂B可选用_______?
① NaOH? ② FeO ? ③ CuO? ④Cu2(OH)2CO3
(3)试剂B的作用是______?
① 提高溶液的pH ② 降低溶液的pH ? ③ 使Fe3+完全沉淀? ④ 使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)
① 过滤? ② 蒸发浓缩? ③ 蒸发至干? ④ 冷却
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _________(用含m、n的代数式表示)。
参考答案:(12分)(1) ①④(2分)
(2) ③④(2分)
(3) ①③?(2分)
(4) ②④①(2分)
(5)二(2分); 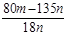 (2分)
(2分)
本题解析:(1)四种试剂都具有强氧化性,为的是制取氯化铜晶体,选用的氧化剂反应后不能生成其它杂质离子,因此选用① Cl2 ④ H2O2。(2)试剂B与氧化剂A选择条件是相似的,因此选用③ CuO④Cu2(OH)2CO3。(3)选择的试剂B,通过与酸的反应生成Cu2+且提高溶液的pH。因在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。所以促使了Fe3+完全沉淀。(4)氯化铜晶体的生成,对滤液先加热蒸发使水份减少溶液浓缩,再冷却结晶,过滤就得到了氯化铜晶体。(5)氯化铜晶体灼烧的温度足以分解氯化铜,氯化铜经过灼烧是不能以氯化铜的形式存在的,会分解为CuO,CuCl2+2H2O Cu(OH)2+2HCl Cu(OH)2
Cu(OH)2+2HCl Cu(OH)2 CuO + H20,固体不可能为纯净的CuCl2,因此第一种方法不正确。第二方案中,最终生成的是CuO,根据铜原子守恒可得:
CuO + H20,固体不可能为纯净的CuCl2,因此第一种方法不正确。第二方案中,最终生成的是CuO,根据铜原子守恒可得:
CuCl2?xH2O → CuO
135+18x ?80
m ?n
(135+18x)/m = 80/n
x=(80m-135n)/18n
点评:解答本题找准考点是关键,考查了盐类水解,注意方案一中最终的固体不可能为纯净的CuCl2。
本题难度:一般
3、选择题 通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实验操作的解释正确的是
| ? | 现象或操作 | 解释 | ||||
| A | 将氯化铁固体溶入加有盐酸的水中配制氯化铁溶液 | 抑制Fe3+的水解 | ||||
| B | 某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 | 该溶液中存在CO32- | ||||
| C | 溴水中加入甲苯,充分振荡后静置,溴水层褪色 | 甲苯与溴水发生了取代反应 | ||||
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高,兜住熔融的铝 参考答案:AD 本题解析:略 本题难度:简单 4、简答题 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图及有关数据如下:按下列合成步骤回答问题:
在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体.继续滴加至液溴滴完.装置d的作用是______;制取溴苯的化学方程式______.该反应的催化剂为______. (2)液溴滴完后,经过下列步骤分离提纯: ①向a中加入10mL水,然后过滤除去未反应的铁屑; ②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:______. ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是______; (3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母); A.重结晶?B.过滤?C.蒸馏?D.萃取 (4)在该实验中,a的容积最适合的是______(填入正确选项前的字母). A.25mL?B.50mL?C.250mL?D.500mL (5)取反应后烧杯中的溶液2ml加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成,______(能或不能)证明苯与液溴反生了取代反应,为什么?______. 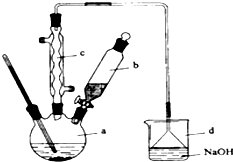 参考答案:(1)铁和溴反应生成三溴化铁,三溴化铁与苯作用,生成溴苯,同时有溴化氢生成,2Fe+3Br2=2FeBr3,C6H6+Br2FeBr3 本题解析: 本题难度:一般 5、实验题 硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。? 参考答案:(1)①NH4++OH- 本题解析: 本题难度:一般 |