时间:2025-06-26 01:53:25
1、选择题 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是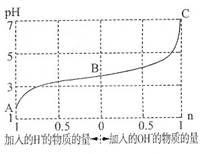
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
参考答案:B
本题解析:A、A点H+浓度最大,对水的电离程度抑制作用最强,C点pH=7,对水的电离程度无抑制作用,所以A、B、C三点所表示的溶液中水的电离程度依次增大,正确;B、温度不变,HA的电离常数不变,错误;C、根据图像,加入1 mol NaOH后,溶液的pH=7,则c(H+)=c(OH?),根据电荷守恒可得c(H+)+c(Na+)=c(OH?)+c(A-),所以c(Na+)=c(A-),正确;D、未加HCl和NaOH时,溶质为HA和NaA,有图像可知pH<7,溶液显酸性,HA的电离程度大于NaA的水解程度,所以c(A-)>c(Na+)>c(HA),正确。
本题难度:一般
2、选择题 下列叙述正确的是(?)
A.10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合: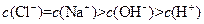
B.0.1mol/L PH为4的NaHB的溶液中,c(HB—)> c (H2B)> c (B2 —)
—)
C.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c (H+):①>②>③
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列溶液呈中性的是
A.pH=7的溶液
B.c(H+) = c(OH-)的溶液
C.由强酸、强碱等物质的量反应制得的溶液
D.非电解质溶于水得到的溶液
参考答案:B
本题解析:只要溶液中氢离子浓度和OH-浓度相等,溶液就显中性,所以只有选项B是正确的,其余都是错误的,答案选B。
本题难度:一般
4、填空题 若100 ℃时纯水电离出的H+浓度为1.0×10-6 mol·L-1,则此时KW= ,c(OH-)= ;25 ℃时的c(H+)=10-2 mol·L-1的硫酸溶液和c(H+)=10-12 mol·L-1的氢氧化钠溶液温度均升高到100 ℃,H+浓度分别是多少?
参考答案:10-12 1.0×10-6 mol·L-1 10-2 mol·L-1 10-10 mol·L-1
本题解析:纯水电离出的H+浓度与纯水电离出的OH-浓度相等,均为1.0×10-6 mol·L-1,此时KW=10-12;25 ℃时的c(H+)=10-2 mol·L-1的硫酸溶液温度升高到100 ℃时,c(H+)不变仍为10-2 mol·L-1;而此温度下c(H+)=10-12 mol·L-1的氢氧化钠溶液温度升高到100 ℃时,c(OH-)也不变,仍为10-2 mol·L-1,而c(H+)=KW/c(OH-)= mol·L-1=10-10 mol·L-1。
本题难度:一般
5、选择题 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是(? )
A.a<7时,水的电离受到抑制
B.a>7时,水的电离被促进了
C.a<7时,溶液的pH一定为a
D.a>7时,溶液的pH一定为14-a
参考答案:C
本题解析:A错误 如a=5时c(H+)=1×10-5摩尔每升大于1×10-7mol/L,水的电离度增大故水的电离被促进了;
B错误 与A相反,应为水的电离受到抑制;
C 正确 a<7时,溶液显酸性由水电离出的氢离子忽略不计故知溶液的pH一定为a
D 错误 a>7时,溶液显碱性,溶液的pH一定也为a
本题难度:一般