时间:2025-06-26 01:50:04
1、计算题 将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
参考答案:(1)1.12?(2)0.2?(3)①
本题解析:(1)根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2CO2=2Na2CO3+O2↑
2? 22.4L
7.8g/78g/mol? x
求得x=1.12L,故生成氧气的体积为1.12L;
(2)溶液物质的量浓度为0.1mol/500×10-3L=0.2mol/L;
(3)配制上述溶液时转移溶液后没有洗涤烧杯和玻璃棒会导致溶质转移的不完全,溶液浓度偏低;配制溶液时容量瓶中有少量水,对实验无影响;在定容时,俯视刻度线会导致蒸馏水的体积减少,浓度偏高。
本题难度:一般
2、选择题 自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶
石中混有Fe2O3,取一定量样品5.4 g,恰好与一定浓度100 mL盐酸反应,盐酸浓度可能是(?)
A.4.9 mol·l-1
B.4.3 mol·L-1
C.3.1 mol·L-1
D.2.2 mol·L-1
参考答案:D
本题解析:本题可采用极值法解答:
①若混合物中只有MgAl2O4没有Fe2O3,则有
MgAl2O4+8HCl=MgCl2+2AlCl3+4H2O
142 g? 8 mol
5.4 g? 0.10 L·c(HCl)
c(HCl)=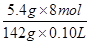 ≈3.0 mol·L-1。
≈3.0 mol·L-1。
②若混合物中只有Fe2O3没有MgAl2O4,则有:
Fe2O3+6HCl=2FeCl3+3H2O
160 g 6 mol
54 g 0.10 L×c(HCl)
c(HCl)=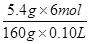 ≈2.0 mol·L-1。
≈2.0 mol·L-1。
综上可知:2.0 mol·L-1<c(HCl)<3.0 mol·L-1。
本题难度:一般
3、选择题 当O2和O3的物质的量比之为3∶2时,它们具有相同的。
A.原子数
B.体积
C.摩尔质量
D.分子数
参考答案:A
本题解析:n(O2):n(O3)= 3∶2则他们的氧原子数目之比为:3×2:2×3=1:1即分子数相等。故正确选项为D。
本题难度:简单
4、填空题 (10分)
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是?。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是_______。(填序号)
①NaAlO2 ?② Ca(OH)2?③Na2CO3?④Al(OH)3
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是
?;过一会儿,溶液颜色逐渐褪去,起作用的成分是?;?
(4)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式?。
参考答案:(1) H2?(2)④?(3)HCl或H+、HClO
(4)5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2
本题解析:(1)质量相同的O2、NH3、H2、Cl2四种气体中,由V=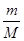 ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
(2)物质中即与酸反应又与碱反应的主要有:特殊的单质(Al、Zn、Cl2、S、Si 等)、两性化合物(ZnO、AI2O3、Al(OH)3等)、弱酸的酸式盐(NaHS、NaHCO3等)、弱酸的铵盐(NH4)2CO3等)、部分化合物(SO2、NO2等)、氨基酸。
(3)氯水溶液中存在反应:Cl2+H2O?HCl+HClO,是可逆反应,存在电离:H2O H++OH-、HClO
H++OH-、HClO H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
(4)将a mol Cl2通入含b mol FeBr2的溶液中,还原性Fe2+>Br―,所以通入氯气,Fe2+先被氯气氧化,反应完后再通氯气,Br―被氧化。所以当0< a / b≤1/2时,只有Fe2+被氧化,所以发生反应2Fe2++Cl2 =2Fe3++2Cl-;当 a / b =1时,Fe2+全部被氧化,Br―是Fe2+的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2+2Fe2++2Br―=?2Fe3++Br2+4Cl―;当a / b≥3/2时,Fe2+、Br―全部被氧化,所以反应为3Cl2+2Fe2++4Br―=2Fe3++2Br2+6Cl―。标准状况下把11.2L氯气物质的量是0.5mol,500ml0.8mol/LFeBr2物质的量是0.4mol,氯气与FeBr2的物质的量比是5:4,介于1/2和3/2之间,Fe2+全部被氧化,Br―有剩余所以氯气与Fe2+全部反应完,得5Cl2+4Fe2++Br― ?Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
?Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1mol·L-1氢氧化钠溶液中含钠离子数为0.1NA
B.7gCnH2n中含氢原子数为NA
C.1mol C5H12分子中共价键总数为13NA
D.标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为2NA
参考答案:B
本题解析:略
本题难度:一般