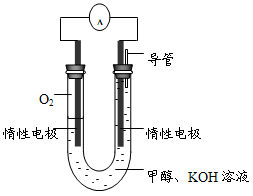
时间:2025-06-26 01:42:46
1、选择题 在一定温度下,2L密闭容器内,反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007 |
2、填空题 (13分)碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。
A.升高温度
B.增加碳的用量
C.加入催化剂
D.用CO吸收剂除去CO (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。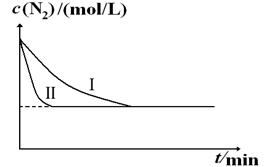
3、选择题 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH="Q" kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH="Q" kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| 气体体积/L c(Y)/(mol·L-1) 温度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
4、选择题 2007年国家最高科学技术奖授予石油化工催化剂专家闵恩泽教授,以表彰他在催化剂研究方面做出的突出贡献。下列关于催化剂的说法中正确的是
[? ]
A.使用催化剂可以增大正反应速率,减小逆反应速率
B.使用催化剂可以提高反应物的转化率
C.使用催化剂可以降低反应的活化能
D.使用催化剂可以改变反应的平衡常数
5、填空题 (1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g); ΔH1
CH3OH(g); ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +H2O(g);ΔH2
CH3OH(g) +H2O(g);ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |