时间:2025-06-26 01:39:23
1、选择题 氯气可用来杀菌消毒,又可作漂白剂,其中起作用的是( )
A.Cl2
B.HClO
C.HCl
D.O2
2、选择题 下列说法不正确的是(? )
A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成
D.将足量Cl2通入NaBr、NaI的混合溶液中,反应后将溶液蒸干并充分灼烧,剩余的固体物质成分为NaCl
3、实验题 某同学用滴管将新制氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去。
试回答下列问题:
(1)某同学分析产生上述现象的原因可能有两种,请用文字简要说明:
一是:____________________________
二是:____________________________?
(2)请设计一个较简单的实验探究红色褪去的原因。
________________________________________________________
4、实验题 无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。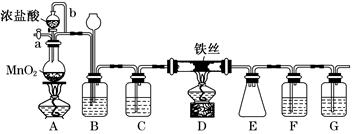
请回答:
(1)装置A中反应的离子方程式为__________________________________________。
(2)装置F中所加的试剂为_________________________________________________。
(3)导管b的作用为_____________________________________________________;
装置B的作用为________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为_______________________________________________________。
(5)反应结束后,拆卸装置前,必须进行的操作是_________________________________
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________(填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
5、选择题 下列物质在水处理过程中肯定不会用到的是( )
A.KAl(SO4)2?12H2O
B.Cl2
C.Ca(ClO)2
D.KNO3