时间:2025-06-26 01:36:13
1、选择题 镁铝合金5.1g溶于300ml 2mol/L HCl溶液时,在标准状况下产生气体5.6L。若向反应后的溶液中加入过量烧碱溶液,则产生沉淀的质量为
[? ]
A.5.8g
B.7.8g?
C.10.4g
D.13.6g
2、选择题 一定条件下,将等体积NO和O2的混合气体置于试管中,并将试管倒立于水槽里的水中,充分反应后剩余气体的体积约为原气体总体积的
[? ]
A. 
B. 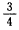
C. 
D. 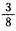
3、选择题 镁和铝分别与等浓度、等体积的稀硫酸反应,在相同条件下测定氢气的体积。下列判断中一定正确的是
[?]
A.若生成H2的体积之比为1:1,则镁和铝的物质的量之比为3:2
B.若镁和铝的物质的量之比为3:2,则生成H2的体积之比为2:1
C.若镁和铝均过量,则生成H2的体积之比为1:1
D.若镁过量,铝不足量,则生成H2的体积之比不可能为1:1
4、选择题 由氧化镁和另一金属氧化物组成的混合物4g,其中含有氧元素1.8 g,则另一种金属氧化物是
[? ]
5、填空题 胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,受热可缓缓分解;
②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;
③遇酸及酸性药物则产生二氧化碳;
④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸是中和作用缓慢而持久,可维持3~4小时;
②凝胶本身覆盖于溃疡面上,具有保护作用;
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是____________(填化学式);乙中含有的主要化学成份是
____________(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:____________________________。
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁改写成氧化物形式为:_________________________。写出它中和胃酸(胃酸的主要成分是HCl)的化学方程式_______________________________。
(4)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO)。现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50mL3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
则该药剂中三种主要成分的物质的量之比为n(MgCO3):n(Mg(OH)2):n(Al(OH)3)=_________。