时间:2025-06-26 01:33:46
1、选择题 已知: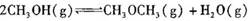
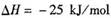 ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
下列说法正确的是
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)="1.6" mol/L
C. 平衡
参考答案:
本题解析:
本题难度:一般
2、选择题 在容积不变的密闭容器中,一定条件下发生反应:2A 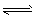 B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
[? ?]
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入稀有气体,则平衡向右移动
参考答案:C
本题解析:
本题难度:一般
3、选择题 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
| A | 加压有利于提高SO2的转化率 | 工业生产硫酸常在高温下进行 | Ⅰ对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用来漂白纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对,Ⅱ错;无 |
| C | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对;有 |
参考答案:D
本题解析:A、加压可以提高二氧化硫的转化率,但实际生产硫酸中的反应条件选择是常压、高温,高温是依据催化剂的活性温度而选择的,二者不具备因果关系,错误;B、二氧化硫与氯气混合会发生氧化还原反应生产两种强酸,二者不能同时使用,I错,错误;C、工业中常用浓硫酸吸收三氧化硫,I错,错误;D、因为石墨的化学性质稳定且具有良好的导电性,所以常用石墨作电极,正确,答案选D。
考点:考查工业中的化学知识,对物质用途的判断
本题难度:一般
4、选择题 将2 mol A和1 mol B充入某密闭容器中发生反应:2A(g)+B(g) xC(g),达到化学平衡后,C的体积分数为
xC(g),达到化学平衡后,C的体积分数为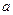 。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是?
。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是?
A.若在恒温恒压下,当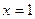 时,按1.5 mol A、l mol C作为起始物质,达到平衡后,? C的体积分数仍为
时,按1.5 mol A、l mol C作为起始物质,达到平衡后,? C的体积分数仍为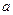
B.若在恒温恒容下,当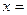 2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为
2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为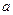
C.若在恒温恒压下,当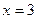 时,l mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为
时,l mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为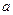
D.若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为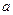 ,则
,则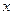 为2或3
为2或3
参考答案:BD
本题解析:当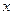 =1时,则反应为2A(g)+B(g)
=1时,则反应为2A(g)+B(g) C(g),按1.5 mol A、1molC作为起始物质,将它们回归后即为按3.5 mol A、1 mol B作为起始物质,则平衡向正向移动,C的体积分数大于
C(g),按1.5 mol A、1molC作为起始物质,将它们回归后即为按3.5 mol A、1 mol B作为起始物质,则平衡向正向移动,C的体积分数大于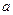 ;当
;当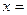 2时,则反应为2A(g)+B(g)
2时,则反应为2A(g)+B(g) 2c(g),将2 mol C作为起始物质,将它回归后即为按2 mol A和1mol B作为起始物质,则与原平衡等效,C的体积分数仍为
2c(g),将2 mol C作为起始物质,将它回归后即为按2 mol A和1mol B作为起始物质,则与原平衡等效,C的体积分数仍为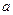 ;当
;当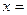 3时,则反应为2A(g)+B(g)
3时,则反应为2A(g)+B(g) 3C(g),按1mol A、1mol B、6mol C作起始物质,将它们回归后即为按5 mol A、3 mol B作为起始物质,则与原平衡不等效,C的体积分数不等于
3C(g),按1mol A、1mol B、6mol C作起始物质,将它们回归后即为按5 mol A、3 mol B作为起始物质,则与原平衡不等效,C的体积分数不等于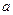 ;D项中当
;D项中当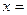 2时,符合回归定值,当
2时,符合回归定值,当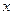 =3时符合回归定比,故与原平衡均等效。
=3时符合回归定比,故与原平衡均等效。
本题难度:一般
5、填空题 (12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。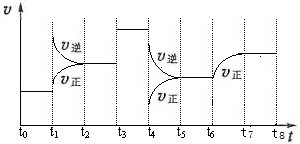
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
(3)t1时刻,改变的外界条件是__________,平衡常数K(t5~t6) ______ K(t7~t8)(填“>、<或=”,下同)。
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
参考答案:(12 分,每空2分)
(1) 50 %; 16(mol?L?1)-2 (2) ACD (3) 升温 ;= (4) >
本题解析:(1)根据N2(g)+3H2(g) 2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
(2)A、该反应前后气体的系数不相等,所以体系总压强不再改变,反应达到平衡;B、反应体系中各气体均为无色,所以混合气体颜色不再改变不能说明建立平衡;C、H2的质量百分含量不再改变,说明反应已达到平衡;D、c(N2)与c(NH3)的比值不再改变,说明c(N2)与c(NH3)不变,反应已达到平衡。
(3)t1时刻,正、逆反应速率都增大,逆反应速率更大,平衡向逆反应方向移动,该反应为放热反应,所以改变的条件是升温;t6正反应速率在原来的基础上逐渐增大,则改变的条件不是温度,所以平衡常数不变,所以K(t5~t6) = K(t7~t8)。
(4)向容器中加入2molN2和2molNH3,c(N2)=(1mol+2mol)÷2L=1.5mol?L?1,c(NH3)=(2mol+2mol)÷2L=2mol?L?1,则浓度积=(2mol?L?1)2÷[1.5mol?L?1×(0.5mol?L?1)3]=21.3(mol?L?1)-2 > K,平衡向正反应方向移动,所以v正 > v逆。
考点:本题考查转化率的计算、化学平衡常数的计算及计算、化学平衡状态的判断、化学平衡移动。
本题难度:困难