时间:2025-06-26 01:32:08
1、填空题 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中A、H为常见的金属单质,气体D、E为单质,试回答: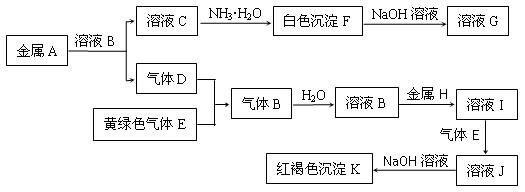
(1)A元素的原子结构示意图为 ________________
(2)写出下列物质的化学式:E是____________ , K是 _________
(3)化合物B属于 ____________化合物(填“离子”或“共价”)
(4)写出反应“F→G”的化学方程式:________________________________________
(5)写出反应“I→J”的离子方程式:_________________________________________
参考答案:(8分)(1)略? (1分)?
(2)E:Cl2? (1分)? K:Fe(OH)3 ?(1分)
(3)共价 (1分)?
(4)Al(OH)3 + NaOH = NaAlO2 + 2H2O?(2分)
(5) 2Fe2+ + Cl2 = 2Fe2++2Cl-?(2分)
本题解析:略
本题难度:简单
2、填空题 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应时可观察到苍白色火焰,其产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
(1)写出D与A反应的离子方程式:
D+A:______.
在D溶液中滴加硫氰化钾,溶液变为红色,相关离子方程式:______.
(2)写出在F中加入NaOH并在空气中放置所发生的反应的化学方程式(涉及两步变化):______、______.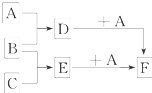
参考答案:A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色则D是氯化铁,A、B都是单质,且A是固体,所以A是铁,B是氯气;B和C反应时可观察到苍白色火焰,其产物极易溶于水得无色溶液E,则C是氢气,E是氯化氢,盐酸和铁反应生成氯化亚铁,则F是氯化亚铁,
(1)氯化铁和铁反应生成氯化亚铁,离子反应方程式为:2Fe3++Fe═3Fe2+,铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,离子反应方程式为:Fe3++3SCN-═Fe(SCN)3,
故答案为:2Fe3++Fe═3Fe2+,Fe3++3SCN-═Fe(SCN)3;
(2)氯化亚铁和氢氧化钠反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁,反应方程式为:FeCl2+2NaOH═Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:FeCl2+2NaOH═Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
本题解析:
本题难度:简单
3、填空题 (14分)(I)、A、B、C、D、E、F六种物质的组成元素均为短周期元素,它们的转化关系如图。其中反应①为置换反应。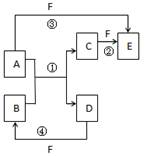
(1)若A、D、F为非金属单质,且A、D同主族,A、F同周期,则F是??,反应①的化学方程式为??;
(2)(若B、C、F都是气态单质,且B有毒,③、④反应中都有水生成,反应②需在放电条件下进行,写出反应①的化学方程式为??,反应③为?热反应
(3)若A、D为单质,且所含元素的原子序数A是D的两倍,原子的最外层电子数D是A的两倍, F是D相邻元素的最高氧化物的水化物,反应①的实验现象是:
反应④的化学方程式为??(F为浓溶液)
(II)X、Y、Z、W 4种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核41个质子的负一价阴离子;④W元素原子最外电子层上的电子数占其电子总数的三分之二。据此填空: Y元素是?,Z元素是?。由W、Z两元素所形成的含22个电子的化合物A的结构式是?;由X、Y、Z三元素按原子个数比为1:1:1形成的化合物B的电子式是?。
参考答案:(14分)(I)O2?( 1分)? SiO2+ 2C?=SiO2?+2CO( 2分)
2NH3+ 3Cl2?= N2+6HCl?( 2分)放热( 1分)?镁条燃烧,发出白光,生成黑白两种固体( 2分)? C +4HNO3(浓)?=CO2↑+4NO2↑+2H2O ( 2分)(条件略)
(II)Cl( 1分)、O( 1分)? ,O=C=O( 1分) ,K+〔︰O︰Cl︰〕-( 2分)
本题解析:(1)同主族间的非金属单质的置换反应,符合题意的只有SiO2与C的反应。
(2)突破口在于反应②需在放电的条件下进行,则为N2与O2放电反应生成NO气体。且B为有毒气体单质,通常为CL2,即可知反应①为工业上检查氯气是否泄漏的方法。反应③这为氨的催化氧化,属于放热反应。
(3)符合A、D为单质,且所含元素的原子序数A是D的两倍,的置换反应为Mg与CO2气体的反应。
(II)X、Y、Z、W 4种元素对应的元素符号为:K、CL、O、C。
本题难度:简单
4、简答题 某混合物A,含有Al2(SO4)3、Al2O3、和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: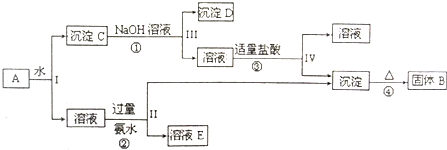
据此回答下列问题:
(1)I、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是______.
(2)根据上述框图反应关系,写出B、E所含物质的化学式B______;溶液E______.
(3)写出反应①、②、③的离子方程式
①______
②______
③______.
参考答案:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液是硫酸铝溶液,沉淀C是氧化铝和氧化铁,将沉淀C溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀D是氧化铁,溶液是偏铝酸钠溶液,向偏铝酸钠溶液加入适量盐酸,得到的沉淀是氢氧化铝,溶液是氯化钠溶液,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,所以溶液E是硫酸铵.
(1)分离溶液和固体的操作是过滤;
故答案为:过滤;
(2)通过以上分析知,B是Al2O3,E是(NH4)2SO4;
故答案为:Al2O3,(NH4)2SO4;
(3)①氧化铝和氢氧化钠、水反应生成四羟基合铝酸钠,离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-;
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
②硫酸铝和氨水反应生成氢氧化铝和硫酸铵,离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
③四羟基合铝酸钠和盐酸反应生成氢氧化铝和水,离子方程式为[Al(OH)4]-+H+=Al(OH)3↓+H2O;
故答案为:[Al(OH)4]-+H+=Al(OH)3↓+H2O.
本题解析:
本题难度:一般
5、填空题 (13分)物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)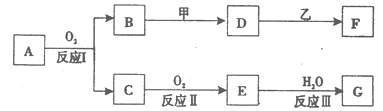
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
①反应Ⅲ的化学方程式为_______________________?___________________。
②D与乙反应的离子方程式为___________________________?_________
(2)第二种情况:甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一 ;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________
生产设备名称为:?
②D和乙反应的离子方程式为____________________________________?
③请简述检验D溶液中阳离子的方法?。
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=?(列出计算式即可)。
参考答案:(13分)
(1)①3NO2+H2O=NO+2HNO3?(2分)②2Al+2OH-+2H2O = 2AlO2-+3H2↑(2分)
(2)①? 4FeS2+11O2=2Fe2O3+8SO2(反应条件:高温)(2分)?沸腾炉?(1分)
②2Fe3+ + Fe =3Fe2+?(2分)
③取少量G溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子?(2分)
④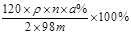 (无“×100% ”也可以;其它合理答案也给分)(2分)
(无“×100% ”也可以;其它合理答案也给分)(2分)
本题解析:略
本题难度:一般