时间:2025-06-26 01:29:38
1、选择题 下列分子所有原子的最外层均为8电子结构的是
[? ]
A.BeCl2
B.H2S
C.NCl3
D.SF6
2、填空题 元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 ?。?
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为 ?
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示) ?
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是?
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是?
(6)如图为石墨晶胞结构示意图,该晶胞中含有碳原子的个数为 ? 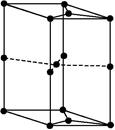
3、选择题 元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X,Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍.下列说法正确的是( )
A.同主族元素中X的气态氢化物最稳定
B.Z的最高价氧化物对应的水化物化学式为H3ZO4
C.X与Y可形成共价化合物
D.X与Z所形成的化合物属于酸性氧化物
4、填空题 (8分,每空2分)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图判断这个分子是极性分子还是非极性分子?_________?。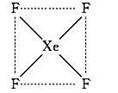
(2)XeF2晶体是一种无色晶体,下图为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?_________;其堆积方式属于__________(填“钾型”“镁型”或“铜型”)。
(3)一个XeF2晶胞中实际拥有XeF2__________个。
5、填空题 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素符号:A______?B______?C______?D______.
(2)写出C2D?的电子式为______.
(3)写出C单质在加热条件下与B单质充分反应的化学方程式______.