时间:2025-06-26 01:29:38
1、填空题 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_______,该化合物由_______键形成的。
(2)Na3N与盐酸反应生成_____种盐,其电子式是______。
(3)Na3N与水的反应属于________反应。
(4)比较Na3N中两种粒子的半径:r(Na+)______r(N3-)(填“大于” “等于”或“小于”)。
参考答案:(1)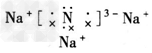 ;离子
;离子
(2)2;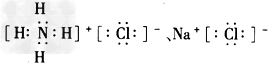
(3)复分解
(4)小于
本题解析:
本题难度:一般
2、填空题 有A、B、C、D、E五种短周期元素,已知A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍;E的最高正价和最低负价代数和为4;C与E同主族;B与D同主族;D+与氖原子具有相同的电子层结构;B元素原子的电子层数与族序数相等.试回答:
(1)元素符号:A______;B______;E______;
(2)写出C在元素周期表中的位置______;
(3)C、D、E原子半径由大到小的顺序是:______;(用元素符号表示)
(4)写出AC2的电子式:______;?B、C、D所形成的化合物的电子式______,并写出所含化学键的类型______;
(5)写出A和D两种元素的最高价氧化物发生氧化还原反应的化学方程式:______.
参考答案:(1)A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍,应为C元素,E的最高正价和最低负价代数和为4,则E为S元素,C与E同主族,应为O元素,D+与氖原子具有相同的电子层结构,则原子核外各层电子数分别为2、8、1,应为Na元素,B与D同主族,B元素原子的电子层数与族序数相等,应为H元素,
故答案为:C;H;S;
(2)C为O元素,原子核外有2个电子层,最外层电子数为6,则应位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(3)C为O元素,D为Na元素,E为S元素,Na与S位于同周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,
S比O元素多一个电子层,电子层数越多,半径越大,则半径S>O,所以原子半径Na>S>O,故答案为:Na>S>O;
(4)AC2对应的化合物为CO2,为共价化合物,电子式为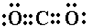
,B、C、D所形成的化合物为NaOH,为离子化合物,电子式为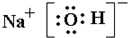
,含有离子键和极性共价键,
故答案为: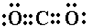
;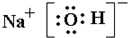
;离子键和极性共价键;
(5)A和D两种元素的最高价氧化物分别为CO2、Na2O2或Na2O,能发生氧化还原反应的为CO2和Na2O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
本题解析:
本题难度:简单
3、选择题 韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。则关于“暖冰”的判断正确的是?
A.“暖冰”中存在离子键
B.“暖冰”中水分子的O-H键是非极性键
C.“暖冰”的密度大,有导电性和导热性
D.水凝固形成20℃时的“暖冰”所发生的变化是物理变化
参考答案:D
本题解析:A.“暖冰”中的水仍然是以分子的形式存在。在分子内存在共价键,不存在离子键。错误。B.“暖冰”中水分子的O-H键是不同元素形成的极性键。错误。C.“暖冰”由于形成时温度高,所以分子间的间隔大。所以密度小。错误。D.水凝固形成20℃时的“暖冰”由于没有产生新的物质,所以所发生的变化是物理变化。正确。
本题难度:一般
4、选择题 据报道,有科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此 时碳、氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬。其原因可能是
[? ]
A.碳、氮原子构成平面结构的晶体
B.碳氮键比金刚石中的碳碳键更短
C.氮原子最外层电子数比碳原子最外层电子数多
D.碳、氮的单质化学性质均不活泼
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列物质属于离子化合物的是( )
A.O3
B.H2O
C.K2SO4
D.C2H5OH
参考答案:C
本题解析:
本题难度:简单