时间:2025-06-26 01:14:07
1、选择题 下列叙述正确的是
[? ]
A.除O族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 ?
B.除短周期外,其他周期均为18种元素 ?
C.副族元素没有非金属元素 ?
D.碱金属元素是指第IA族的所有的元素
2、填空题 类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,根据下表提供的氧族元素的部分性质,结合元素周期律完成下列问题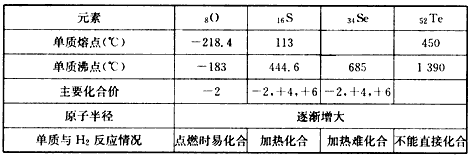
(1)硒的熔点范围可能是________________。
(2)碲的化合价可能有____________。
(3)硫、硒、碲的氢化物的稳定性由强至弱的顺序是_______________(填化学式)。
(4)氢硒酸有较强的___________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为____________________。
3、填空题 在化学符号ZAX中,A表示?_____;Z表示______。
4、推断题 A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等。请按要求回答下列问题:
(1)画出E的离子结构示意图_________,写出由A 和C组成的含有非极性键的化合物的电子式_________。
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是_________。(只要求写出两种,用化学式表示)
(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式__________________
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:__________________
(5)上述元素形成的化合物中通常能污染空气的是_________(至少写出两种)。某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为: __________________
5、选择题 若短周期元素X、Y可形成化合物X2Y3,则X、Y的原子序数之差不可能是
A.1
B.3
C.5
D.6