时间:2025-06-26 01:06:01
1、选择题 下列关于化学反应与能量的说法正确的是
A.铝热反应属于吸热反应
B.对于某一反应,若反应物的总能量大于生成物的总能量,则该反应为吸热反应
C.化学反应中既有物质变化又有能量变化
D.凡经加热而发生的化学反应都是吸热反应
参考答案:C
本题解析:A不正确,铝热反应是放热反应。若反应物的总能量大于生成物的总能量,则该反应为放热反应,B不正确。反应是放热反应还是吸热反应,与反应条件无关,只与反应物和生成物总能量的相对大小有关系,答案选C。
本题难度:简单
2、选择题 分析下面的能量变化示意图,下列热化学方程式正确的是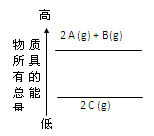
A.2A(g)+ B(g)=2C(g);△H=a(a>0)
B.2A(g)+ B(g)=2C(g);△H=a(a<0)
C.2A + B="2" C;△H=a(a<0)
D.2C="2A" +B;△H=a(a>0)
参考答案:B
本题解析:考查热化学方程式的书写。根据图像可知,A和B的总能量高于C的总能量,所以A和B生成C的反应是放热反应,其逆反应就是吸热反应。所以选项A不正确,选项C和D中没有注明反应物的状态,一定不正确。答案选B。
本题难度:一般
3、选择题 将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)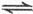 C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是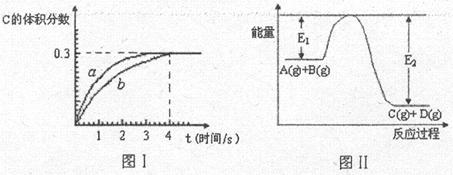
A. 在上述反应体系中加入催化剂,化学反应速率增大,E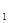 和E
和E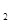 均减小
均减小
B. 该温度下,反应的平衡常数数值约为7.36;若升高温度,该反应的平衡常数减小
C. 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行
D. 反应在第4秒钟达到化学平衡状态,此时以A表示的速率是v(A)=0.225mol·L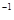 ·s
·s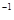
参考答案:D
本题解析:催化剂只能改变活化能不能改变反应热,A正确;从图I可知平衡时C的物质的量为0.9mol,则D为0.9mol,A为0.1mol,B为1.1mol,所以K=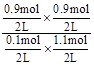 =7.36,从图II可知,该反应为放热反应,升高温度平衡常数减小,B正确;给反应前后气体的体积不变,所以缩小容器的体积只加快反应速率不改变平衡,C正确;4s时A为0.1mol,则v(A)=
=7.36,从图II可知,该反应为放热反应,升高温度平衡常数减小,B正确;给反应前后气体的体积不变,所以缩小容器的体积只加快反应速率不改变平衡,C正确;4s时A为0.1mol,则v(A)=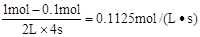 ,D错误。答案选D。
,D错误。答案选D。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
4、计算题 高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体?(填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿)?。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ?ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s)?ΔH2?
③3Fe(s)+2O2(g)=Fe3O4(s)?ΔH3?
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的? H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
参考答案:(16分)
(1)CO(2分)? Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g) (写等号扣1分,不标状态不扣分)(2分)
3Fe(s)+4CO2(g) (写等号扣1分,不标状态不扣分)(2分)
(2)3ΔH1-4ΔH3?(2分)?
(3)NaOH(2分)?酸性条件会反应,KOH会引进K元素杂质(合理也给分)(2分)
Fe-6e-+ 8OH-= FeO42-+ 4H2O (2分)
(4) ?HX? ?X-?+? H+
?X-?+? H+
初始浓度/ mol·L-1: 0.100? 0? 0
变化浓度/ mol·L-1:? a?a? a
平衡浓度/ mol·L-1: 0.100? a? a?(1分)
K=  =
= =1×10-5?∴a≈1×10-3(1+1+1分)
=1×10-5?∴a≈1×10-3(1+1+1分)
(K的表达式正确得1分,算式正确得1分,计算结果正确得1分)。
本题解析:(1)高炉炼铁原理为Fe2O3+3CO 2Fe+3CO2,为了提高氧化铁的利用率及,一氧化碳一定过量,则尾气中含有的有毒气体是CO;产生上述现象的原因是高炉炼铁是可逆反应,则用磁铁矿为原料炼铁的原理为Fe3O4(s)+4CO(g)
2Fe+3CO2,为了提高氧化铁的利用率及,一氧化碳一定过量,则尾气中含有的有毒气体是CO;产生上述现象的原因是高炉炼铁是可逆反应,则用磁铁矿为原料炼铁的原理为Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g);(2)为了约去Fe(s),观察3个热化学方程式,发现①×3—③×4=②,则②的焓变等于①的焓变×3—③的焓变×4,即ΔH2=3ΔH1-4ΔH3;(3)阳极的主要反应物和产物是铁和高铁酸根离子,即Fe→FeO42—;铁元素由0价升为+6价,升高总数为6,则失去6个电子,则Fe—6e—→FeO42—;由于铁单质与酸能直接反应,因此不能选择酸作电解质溶液,也不能用氢离子使左右电荷守恒,只能选碱作电解质溶液,但不能选择KOH,否则引入钾离子等杂质,根据电荷守恒,则Fe—6e—+ 8OH-→FeO42—;根据氢、氧原子个数守恒,则阳极反应式为Fe-6e-+ 8OH-= FeO42-+ 4H2O;(4)依题意,该反应体系中各组分(起始、变化、平衡)浓度可以推导,则
3Fe(s)+4CO2(g);(2)为了约去Fe(s),观察3个热化学方程式,发现①×3—③×4=②,则②的焓变等于①的焓变×3—③的焓变×4,即ΔH2=3ΔH1-4ΔH3;(3)阳极的主要反应物和产物是铁和高铁酸根离子,即Fe→FeO42—;铁元素由0价升为+6价,升高总数为6,则失去6个电子,则Fe—6e—→FeO42—;由于铁单质与酸能直接反应,因此不能选择酸作电解质溶液,也不能用氢离子使左右电荷守恒,只能选碱作电解质溶液,但不能选择KOH,否则引入钾离子等杂质,根据电荷守恒,则Fe—6e—+ 8OH-→FeO42—;根据氢、氧原子个数守恒,则阳极反应式为Fe-6e-+ 8OH-= FeO42-+ 4H2O;(4)依题意,该反应体系中各组分(起始、变化、平衡)浓度可以推导,则
HX? ?X-?+? H+
?X-?+? H+
初始浓度/ mol·L-1? 0.100? 0? 0
变化浓度/ mol·L-1?a?a? a
平衡浓度/ mol·L-1?0.100—a≈0.100? a?a
K=  =
= =1×10-5?∴a≈1×10-3
=1×10-5?∴a≈1×10-3
本题难度:简单
5、选择题 下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H =" +73" kJ/mol,可知石墨比金刚石稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = –285.8kJ/mol
参考答案:D
本题解析:D项的热化学方程式表示的是4g氢气完全燃烧生成液态水放出的热量,所以反应热应为△H = –571.6kJ/mol,所以错误,其余选项均正确。答案选D。
点评:热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。
本题难度:一般