时间:2025-06-26 01:01:54
1、填空题 现有常温下的0.1?mol/L纯碱溶液.
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):______________________.为证明你的上述观点,请设计一个简单的实验,简述实验过程. ___________________________.
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%.请你设计实验证明该同学的观点是否正确____________
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是________.
A.c(Na+)=2c(CO32-)
B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1?mol/L
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
(4)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式________________.
参考答案:(1)CO32-+H2O HCO3-+OH- ;向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO3-+OH- ;向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
(2)用pH试纸(或pH计)测常温下0.1?mol/L纯碱溶液的pH,若pH12,则该同学的观点不正确
(3)BD
(4)Kh=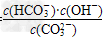
本题解析:
本题难度:一般
2、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是( )
A.[NH4+]>[Cl-]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[H+]>[OH-]
D.[Cl-]>[NH4+]>[OH-]>[H+]
参考答案:B
本题解析:
本题难度:简单
3、选择题 物质的量浓度都为0.1mol?L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是( )
A.[Na+]+[H+]=[OH-]+[CH3COO-]
B.[Na+]>[CH3COO-]>[H+]>[OH-]
C.[OH-]=[H+]+[CH3COOH]
D.[CH3COOH]+[CH3COO-]=[Na+]
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列溶液中离子浓度的关系一定正确的是
[? ]
A.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液:c(CH3COO-)>c(CO32-)>c(C6H5-)
B.pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(X-)>c(H+)=c(OH-)
C.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中:c(K+)=c(H2X)+c(HX-)+c(X2-)
D.氨水中逐滴加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
参考答案:C
本题解析:
本题难度:一般
5、选择题 常温下的下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10mLpH=13的氨水与10mLpH=1的盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Cl-)=c(Na+)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与10mLpH=13的NaOH混合:c(CH3COO-)=c(Na+)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLpH=0的盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:A、pH=13的氨水其浓度大于0.1mol/L,pH=1的盐酸其浓度为0.1mol/L,则混合后溶液中的溶质为氯化铵和一水合氨,一水合氨的电离大于铵根离子的水解,则c(NH4+)>c(Cl-),故A错误;
B、10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液中溶质的物质的量相等,钠离子和氯离子的物质的量浓度相等,该溶液为碱与盐的混合溶液,则显碱性,即c(OH-)>c(H+),又部分氢氧根离子结合铵根离子,则c(Na+)>c(OH-),故B正确;
C、10mL0.1mol/LCH3COOH溶液与10mLpH=13的NaOH溶液中溶质的物质的量相等,恰好完全反应后溶液中的溶质只有醋酸钠,由醋酸根离子水解可知c(Na+)>c(CH3COO-),故C错误;
D、10mL0.5mol/LCH3COONa溶液与6mLpH=0的盐酸中溶质的物质的量的关系为5:6,则c(Cl-)>c(Na+),但盐与酸的混合溶液显酸性,则c(H+)>c(OH-),故D错误;
故选B.
本题解析:
本题难度:简单