时间:2025-06-26 01:01:07
1、选择题 代号为X、Y、Z的三种化合物,在某条件下均能分解,各产生两种产物,而其中有一物质是相同的,如式中的W,反应式如下(反应条件未注明):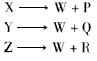
已知:(1)P为一种盐,其水溶液与AgNO3( aq)反应,产生白色沉淀。
(2)Q为只由一种元素构成的可燃气体。
(3)元素R在常温常压为液体,能从AgNO3( aq)中,置换出Ag(s)。试依据上列反应式,推论下列哪些叙述正确
参考答案:CD
本题解析:
本题难度:一般
2、推断题 已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
(1)写出下列物质的化学式;乙___________;B_____________。
(2)写出③反应的化学方程式:___________________________。
(3)写出②反应的离子方程式:___________________________。
参考答案:(1)Cl2;FeCl2
(2)4Fe(OH)2+2H2O+O2==4Fe(OH)3
(3)2Fe3++Fe==3Fe2+
本题解析:
本题难度:一般
3、推断题 下列框图题中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H是呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。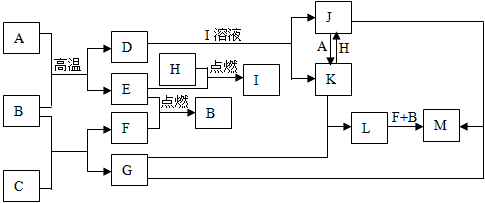
回答下列问题:
(1)写出化学式:C________、I________;
(2)写出离子方程式:
①D+I溶液:____________________; ②K+H:____________________;
(3)写出化学方程式:①B+C:____________________; ②L→M:____________________;
(4)检验J中的阳离子的最好方法是___________________________________。
参考答案:
(1)Na2O2;HCl
(2)①Fe3O4+8H+==Fe2++2Fe3++H2O;②2Fe2++Cl2==2Fe3++2Cl-;
(3)①2Na2O2+2H2O=4NaOH+O2↑;②4Fe(OH)2+2O2+2H2O==4Fe(OH)3
(4)加入KSCN溶液,溶液呈血红色,证明有Fe3+
本题解析:
本题难度:一般
4、填空题 现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。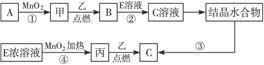
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则②的离子方程式为____
____________________,④的化学方程式为________________________。
(2)若反应①可在常温下进行,则A的名称是_____________。若反应①需在加热条件下进行,则A的名称是_____________,反应的化学方程式为_____________________________。
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C。从C溶液中得到晶体的过程被称为________________________,将得到的晶体转化为C的实验条件是______________________________________。
参考答案:(1)MgO+2H+====Mg2++H2O?
MnO2+4HCl(浓)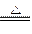 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)双氧水或过氧化氢?氯酸钾? 2KClO3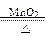 2KCl+3O2↑
2KCl+3O2↑
(3)结晶?在HCl气流中加热(只答加热不得分)
本题解析:(1)本题突破口是“乙元素的+2价离子与Ne原子具有相同的电子层结构”,得知乙元素是Mg。又根据高中阶段只学过以下几个有MnO2参与的反应:2KClO3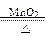 2KCl+3O2↑;2H2O2
2KCl+3O2↑;2H2O2 2H2O+O2↑;MnO2+4HCl(浓)
2H2O+O2↑;MnO2+4HCl(浓)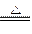 MnCl2+Cl2↑+2H2O。于是不难理出思路。
MnCl2+Cl2↑+2H2O。于是不难理出思路。
(3)防止Mg2+水解。
本题难度:简单
5、填空题 如图中,A、B、C、D、E是单质,F、G、H、I是B、C、D、E分别和A形成的化合物。已知:①G、H的化学式为“X2Y3”形式,F的化学式为“XY”形式;②I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨, E可以在I中燃烧,发生置换反应;③F中的A元素的质量分数为40%。回答问题: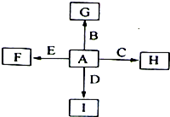
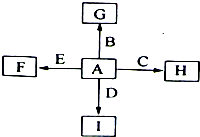
(1)I和E反应的化学方程式为:?。(2分)
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应。C和A形成的化合物H与氢氧化钠溶液反应的离子方程式为:?。(2分)电解H可以制取C, 反应的化学方程式为:?。(2分)
(3)G是一种红棕色粉末,向一定量的G中加入足量硫酸,反应的化学方程式为:?。(2分)向反应后的溶液中加入足量铁粉,反应的离子方程式为:?。(2分)
(4)G与盐酸反应的离子方程式为:?。(2分)得到的溶液中加入铜粉,反应的离子方程式为:?。(2分)1.6g?G?溶于盐酸,得到的溶液与铜粉完全反应,至少需铜粉?g(3分)。
参考答案:(1)2Mg+CO2 2MgO+C(2分)(2)Al2O3+2OH-=2AlO2-+H2O(2分)
2MgO+C(2分)(2)Al2O3+2OH-=2AlO2-+H2O(2分)
2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(2分)2Fe3++Fe=3Fe2+(2分)
(4)Fe2O3+6H+=2Fe3++3H2O(2分)? Cu+2Fe3+=Cu2++2Fe2+(2分)? 0.64g(1分)
本题解析:I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨,这说明I是二氧化碳。E可以在I中燃烧,发生置换反应2E+I=2F+D,推断E为金属单质Mg,发生的反应为,2Mg+CO2 2MgO+C,F为MgO,D为单质C;MgO中的氧元素的质量分数为40%,证明推断正确.因此E是镁,则A是氧气,D是碳,F是氧化镁。
2MgO+C,F为MgO,D为单质C;MgO中的氧元素的质量分数为40%,证明推断正确.因此E是镁,则A是氧气,D是碳,F是氧化镁。
(1)I和E反应的化学方程式为2Mg+CO2 2MgO+C。
2MgO+C。
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应,说明C是金属铝。C和A形成的化合物H是氧化铝,属于两性氧化物与氢氧化钠溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;电解氧化铝可以制取铝, 反应的化学方程式为2Al2O3 4Al+3O2↑。
4Al+3O2↑。
(3)G是一种红棕色粉末,则G是氧化铁。向一定量的G中加入足量硫酸,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;铁离子能氧化单质铁,因此向反应后的溶液中加入足量铁粉,反应的离子方程式为2Fe3++Fe=3Fe2+。
(4)氧化铁与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O;铁离子能氧化单质铜,因此得到的溶液中加入铜粉,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;1.6g?氧化铁的物质的量是1.6g÷160g/mol=0.01mol,根据方程式Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+可知?Fe2O3~Cu,则需要铜的物质的量是0.01mol,铜粉的质量是0.64g。
本题难度:一般