时间:2025-06-26 01:01:07
1、选择题 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X不可能是?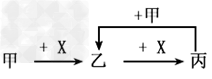
[? ]
A.甲:C、X:O2?
B.甲:SO2、X:NaOH溶液?
C.甲:Fe、X:Cl2
D.甲:AlCl3溶液、X:NaOH溶液?
参考答案:C
本题解析:
本题难度:一般
2、填空题 (4分)在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。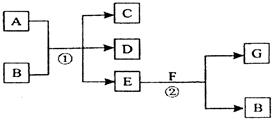
回答下列问题:
(1)A、G的化学式分别为____________、__________。
(2)写出反应②的化学方程式_______________________?_____。
参考答案:(1) Cl2 ;? O2?(各1分,)? (2) 2 Na2 O2 + 2 H2O ="4" NaOH + O2↑(2分)
本题解析:E常温下为无色无味的液体,所以E是水。F为淡黄色粉末,则F是过氧化钠。过氧化钠溶于水生成氢氧化钠和氧气,所以G是氧气,B是氢氧化钠。由于反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,所以A是氯气,C、D是氯化钠和次氯酸钠。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
3、填空题 (16分)A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去):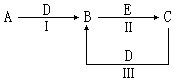
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C的电子式为_______________.
②写出反应Ⅱ的化学方程式______________________.
(2)若A是淡黄色化合物,常温下D是无色气体,C中含有的阴、阳离子均为10电子粒子.
①C中所含化学键的类型是____________.
②写出反应Ⅲ的离子方程式______________________.
(3)将(2)中一定量的气体D通入2 L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).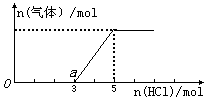 ?
?
①O点溶液中所含溶质的化学式为_____________,a点溶液中各离子浓度由大到小的关系是_______________.
②标准状况下,通入气体D的体积为_____L,C溶液的物质的量浓度为_____mol·L-1.
参考答案:(1)①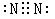 (2分)?② 2NO + 2CO
(2分)?② 2NO + 2CO 2CO2 + N2(2分)
2CO2 + N2(2分)
(2)①离子键、共价键(2分)?② 2OH- + CO2 = CO32- + H2O (2分)
(3)① Na2CO3、NaOH (2分)? c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) (2分)?
② 44.8 (2分)? 2.5 (2分)
本题解析:(1)若A是能使湿润的红色石蕊试纸变蓝的气体,则A是氨气,所以D是氧气,B是NO,则C是氮气,电子式为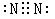 。由于E有毒,所以E是CO。NO具有氧化性,能氧化CO,生成CO2和氮气,方程式为2NO + 2CO
。由于E有毒,所以E是CO。NO具有氧化性,能氧化CO,生成CO2和氮气,方程式为2NO + 2CO 2CO2 + N2。
2CO2 + N2。
(2)若A是淡黄色化合物,则A是过氧化钠;常温下D是无色气体,所以D是CO2,则B是碳酸钠;C中含有的阴、阳离子均为10电子粒子,则C是氢氧化钠,含有离子键、共价键。E是氢氧化钙或氢氧化钡等。CO2和氢氧化钠反应的方程式为2OH- + CO2 = CO32- + H2O。
(3)(3)①由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O=CO2↑。所以根据图像可知所得溶液中含有氢氧化钠,即O点溶液中所含溶质的化学式为Na2CO3、NaOH;a点溶液恰好是碳酸氢钠,由于水解程度大于电离程度,溶液显碱性,所以离子浓度大小关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
②根据图像可知,生成CO2是2mol,则所得溶液中含有碳酸钠是2mol,所以消耗CO2是2mol,标准状况下的体积是44.8L;最终生成氯化钠是5mol,所以根据原子守恒可知,氢氧化钠是5mol,浓度是2.5mol/L。
本题难度:一般
4、填空题 (10分)已知T、X、Y、Z是四种常见的短周期元素,其结构或性质信息如下表。请填空:
(1)写出与Y2互为等电子体的物质的分子式?。
(2)写出Y的最简单气态氢化物的结构式?。
(3)元素Q的原子序数比X与Z的原子序 数之和还多1。
数之和还多1。
①该元素基态原子的价电子排布式为? ?。
?。
②向含Q离子的水溶液中逐滴加入Y的简单氢化物的水溶液至过量,写出有关反应的离子方程式?、?。
参考答案:(每空2分 ,共10分)
,共10分)
(1)CO?(2)NH3的结构式
(3)① 3d104s1
②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
本题解析:略
本题难度:一般
5、填空题 (6分)A为常见金属,D、E为常见非金属单质,D为黑色固体,E是常温下密度最小的气体,B、F是同种非金属化合物气体,A与氧气转化为C的过程中发出耀眼的白光,A→F之间的转化关系如图:按要求完成下列各题: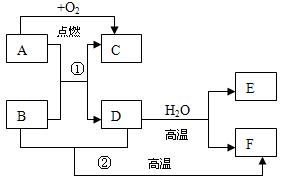
(1)写出A与F的化学式:A__________? F__________
(2)下列物质中有一种与B物质不属于同一类,其他与B均属于同一类,这一物质是_______
A.P2O5?B.NO?C.Na2O? D.SiO2
(3)D高温情况下与水蒸气恰好完全反应生成E和F时,所得气体的平均相对分子质量是__________g/mol
(4)写出反应①的方程式:_______________________
参考答案: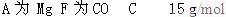
本题解析:略
本题难度:一般