时间:2025-06-26 00:48:50
1、选择题 胶体区别于其它分散系的本质是
A.胶体粒子直径在1-100nm之间
B.胶体粒子有颜色
C.胶体是一种混合物
D.光束通过胶体时有丁达尔效应
参考答案:A
本题解析:
本题难度:简单
2、填空题 (8分)在下列化学方程式中,指出氧化剂和还原剂,氧化产物和还原产物。
(1)3S+6KOH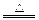 K2SO3+2K2S+3H2O
K2SO3+2K2S+3H2O
(2)S+2KNO3+3C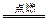 K2S+N2+3CO2
K2S+N2+3CO2
(1)氧 化 剂 还 原 剂 氧化产物 还原产物
(2)氧 化 剂 还 原 剂 氧化产物 还原产物
参考答案:(1)S;S;K 2SO3;K2
2SO3;K2 S (2)
S (2) S、KNO3;C;CO2;K2S,N2
S、KNO3;C;CO2;K2S,N2
本题解析:略
本题难度:一般
3、选择题 下列变化过程中,属于还原反应的是
A.HCl→Cl2
B.Na→Na+
C.CO→CO2
D.Fe3+→Fe
参考答案:D
本题解析:试题分析:A、氯元素由—1价升为0价,发生氧化反应,错误;B、钠元素由0价升为+1价,发生氧化反应,错误;C、碳元素由+2价升为+4价,发生氧化反应,错误;D、铁元素由+3价降为0价,发生还原反应,正确。
考点:考查还原反应、氧化反应等相关知识。
本题难度:困难
4、选择题 黑火药发生爆炸的反应中:S+2KNO3+3C=K2S+N2↑+3CO2↑被还原的元素是
A.只有N
B.只有S
C.N和S
D.只有C
参考答案:C
本题解析:根据反应的方程式可知,S元素的化合价从0价降低到-2价,得到电子,被还原;硝酸钾中氮元素的化合价从+5价降低到0价,得到电子,被还原;碳元素的化合价从0价升高到+4价,失去电子,被氧化,所以被还原的元素是N和S,答案选C。
考点:考查氧化还原反应的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题的关键是准确标出有关元素的化合价变化情况,然后根据有关的概念灵活运用即可。
本题难度:一般
5、选择题 下列变化,需要加入适当的氧化剂才能完成的是( )
A.PCl3→PCl5
B.MnO4- →Mn2+
C.SO2→SO32-
D.FeCl3→FeCl2
参考答案:A
本题解析:氧化剂在反应中得到电子,化合价降低。这说明题中所给的物质是还原剂,失去电子化合价升高,所以答案选A。
考点:氧化还原反应的有关判断
本题难度:一般