时间:2025-06-26 00:47:12
1、填空题 (1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42-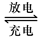 ?2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
?2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是?, 电解液中H2SO4的浓度将变________,当外电路通过2mol电子时,理论上负极板的质量增加?g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板 按下图连接,电解一段时间后,则在A电极上生成 __________,B电极上?生成________。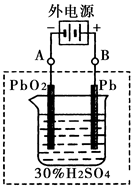
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是?
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
参考答案:(1)①Pb+SO42- -2e-? = PbSO4?
小?96
②Pb; PbO2;
(2)cd
本题解析:(1)①Pb+PbO2+4H++2SO42-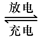 ?2PbSO4+2H2O,该反应中Pb作为负极,所以负极的电极反应式是Pb+SO42- -2e-? = PbSO4?,反应过程中消耗了硫酸,所以电解液中H2SO4的浓度将变小;该反应转移的电子数为2,所以当外电路通过2mol电子时,即有1mol的Pb发生反应,所以在负极增加一摩尔硫酸根的质量,即负极板的质量增加96g;②该过程为放电的逆过程,所以在A电极上生成Pb,在B电极上?生成PbO2;(2)阳极发生的是氧化反应,所以不能用铁作阳极材料,a错误;阳极反应方程式为:2Cl--2e-=Cl2↑,Cl2在弱碱性条件下生成ClO-,故电解过程中阳极附近溶液的pH降低,所以b错误,c正确,1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故d正确,本题答案选择cd。
?2PbSO4+2H2O,该反应中Pb作为负极,所以负极的电极反应式是Pb+SO42- -2e-? = PbSO4?,反应过程中消耗了硫酸,所以电解液中H2SO4的浓度将变小;该反应转移的电子数为2,所以当外电路通过2mol电子时,即有1mol的Pb发生反应,所以在负极增加一摩尔硫酸根的质量,即负极板的质量增加96g;②该过程为放电的逆过程,所以在A电极上生成Pb,在B电极上?生成PbO2;(2)阳极发生的是氧化反应,所以不能用铁作阳极材料,a错误;阳极反应方程式为:2Cl--2e-=Cl2↑,Cl2在弱碱性条件下生成ClO-,故电解过程中阳极附近溶液的pH降低,所以b错误,c正确,1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故d正确,本题答案选择cd。
点评:本题考查了原电池、电解池的知识,该考点是高考考查的重点和难点,本题有一定的综合性,难度适中。
本题难度:一般
2、选择题 下列事实与电化学腐蚀无关的是? ( )。
A.光亮的自行车钢圈不易生锈
B.黄铜(Cu、Zn合金)制的铜锣不易产生铜绿
C.铜、铝电线一般不连接起来作导线
D.生铁比熟铁(几乎是纯铁)容易生锈
参考答案:A
本题解析:自行车钢圈外面镀了一层不易发生化学变化的金属,阻止了钢铁与空气的接触,所以不易生锈,与电化学腐蚀无关。
本题难度:一般
3、选择题 将铁制零件与下列哪种金属或非金属接触时,可以减少空气和水对铁的腐蚀:
A.铜
B.银
C.石墨
D.锌
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (9分)按要求对下图中两极进行必要的联接并填空: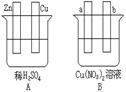
(1)在A图中,使铜片上冒H2气泡。请加以必要联接,则联接后的装置叫?。电极反应式:
锌板:?;铜板:?。
(2)在B图中,a和 b都是石墨电极,使a极析出铜,则b析出:?。加以必要的联接后,电极反应式,a极:??b极:?。经过一段时间后,停止反应后加入一定量的?,溶液能恢复至与电解前完全一致。
参考答案:(1)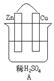 ?原电池?,锌板:Zn-2e- =Zn2+铜板:2H++2e-=H2↑
?原电池?,锌板:Zn-2e- =Zn2+铜板:2H++2e-=H2↑
(2)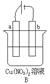 O2,电解池,a极:Cu2++2e- =Cu,b极:4OH――4e-=O2↑+2H2O,CuO(每空1分,未连线或连线错误酌情扣分)
O2,电解池,a极:Cu2++2e- =Cu,b极:4OH――4e-=O2↑+2H2O,CuO(每空1分,未连线或连线错误酌情扣分)
本题解析:(1)要使铜片上产生气泡,则应该构成原电池,锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子,电极反应式为锌板:Zn-2e- =Zn2+铜板:2H++2e-=H2↑。
(2)使a极析出铜,应该构成电解池,其中a极是阴极,所以b极是阳极,b极OH-放电,生成氧气。电极反应式分别是a极:Cu2++2e- =Cu,b极:4OH――4e-=O2↑+2H2O。由于从溶液中减少的是铜和氧气,所以应该加如氧化铜才能恢复到电解前到状态。
本题难度:简单
5、选择题 下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 
[? ]
A.4>2>1>3>5
B.2>1>5>3>4
C.5>4>2>3>1
D.3>5>2>4>1
参考答案:A
本题解析:
本题难度:一般