时间:2025-06-26 00:46:23
1、选择题 下列离子反应方程式书写正确的是( )
A.用烧碱溶液吸收Cl2:C12+2OH-=Cl-+ClO-+H2O
B.铜丝在氯气中燃烧:Cu+Cl2=Cu2++2Cl-
C.向碳酸钙表面上滴加稀盐酸:CO32-+2H+=H2O+CO2↑
D.将金属钠投入到冷水中:Na+2H+=Na++H2↑
2、选择题 下列离子方程式书写正确的是?
[? ]
A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ ?
B.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O ?
C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
3、选择题 能正确表示下列化学反应的离子方程式或化学方程式的是( )
A.用两个铁电极电解氢氧化钠溶液:2H2O
? |
4、填空题 【化学——选修2:化学与技术】(15分)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: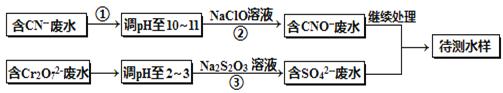
(1)上述处理废水流程中主要使用的方法是_________________;
(2)②中反应后无气体放出,该反应的离子方程式为______________;
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应的离子方程式为?;
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因?;
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于: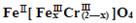 (铁氧磁体,罗马数字表示元素价态)的沉淀。
(铁氧磁体,罗马数字表示元素价态)的沉淀。
处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
A.x ="0.5" ,a ="8"
B.x ="0.5" ,a =" 10"
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
5、选择题 下列化学反应的离子方程式正确的是?
A.碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.金属铝溶于氢氧化钠溶液:2Al+6OH-=2AlO2-+3H2
C.用FeCl3溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+
D.纯碱溶液中滴入醋酸:CO32-+2H+=H2O+CO2