时间:2025-06-26 00:43:56
1、选择题 已知2.5克KClO3粉未和5.2克研细的碘在一定条件下按下式定量反应:
a KClO3 + bI2 + cHCl = eIClx + fKCl + gH2O,其中x的取值为
A.1
B.3
C.5
D.7
参考答案:B
本题解析:氯酸钾和碘单质的物质的量分别是0.02mol,则氯酸钾在反应中得到0.12mol,所以1mol单质碘即失去6mol电子,则碘在氧化产物中的价态是+3价,即x=3,答案选B。
本题难度:简单
2、选择题 下列变化中,必须加入氧化剂才能发生的是(?)
A.SO2→S
B. →SO2
→SO2
C.I-→I2
D. →
→
参考答案:C
本题解析:选项中只有C项碘的化合价升高被氧化,故选C。
本题难度:简单
3、填空题 (8分)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质,其化学反应式为:2NaIO3+5NaHSO3====3NaHSO4+2Na2SO4+I2+H2O
(1)反应中______________是氧化剂。
(2)用单线桥标出电子转移方向和数目?
(3)从反应产物中,所得氧化产物与还原产物物质的量之比为___?_。
参考答案::(1)NaIO3,(2)10e-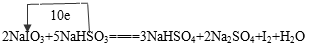
(3)5:1
本题解析:(1)NaIO3中的I化合价由+5降至0价,做氧化剂;NaHSO3中的S化合价由+4升至+6价,做还原剂。
(2)?转移电子数=化合价的差值的绝对值?参加反应原子个数,不难算出为10e-。
(3)反应中氧化产物为3NaHSO4+2Na2SO4,还原产物为I2,故氧化产物与还原产物物质的量之比为5:1。
点评:掌握氧化还原反应的概念不难判断,另外掌握氧化还原反应的相关计算。
本题难度:一般
4、填空题 配平下列氧化还原方程式,并完成以下问题。
(1)P4+HNO3+H2O——H3PO4+NO↑,该反应中氧化产物是_____________________。
(2)Fe+H2SO4(浓) Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
参考答案:(1)H3PO4?(2)铁?二氧化硫
本题解析:(1)配平为:3P4+20HNO3+8H2O====12H3PO4+20NO↑,氧化产物是 H3PO4
(2)2Fe+6H2SO4(浓)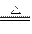 Fe2(SO4)3+3SO2↑+6H2O,此反应中,被氧化的元素名称是铁元素,所得还原产物名称为二氧化硫。
Fe2(SO4)3+3SO2↑+6H2O,此反应中,被氧化的元素名称是铁元素,所得还原产物名称为二氧化硫。
本题难度:简单
5、选择题 下列反应中酸只表现氧化性,不表现酸性的是
A.2HNO3(浓)+Ag ="===" AgNO3+H2O+NO2↑
B.2H2SO4 (浓)十C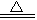 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(稀)+CuO====CuSO4+H2O
D.2HNO3(稀)+CaCO3="===Ca" (NO3) 2+CO2↑+H2O
参考答案:B
本题解析:酸必须酸性的标志是有相应的盐生成,表现氧化性的标志是酸中有关元素的化合价降低。选项B中硫酸全部被还原,生成了SO2,没有硫酸盐生成,只表现氧化性,不表现酸性。ACD中均有相应的盐生成,表现了酸性。其中A和D既表现酸性还表现氧化性,C中只表现酸性。所以答案选B。
本题难度:简单