时间:2025-06-26 00:42:19
1、选择题 室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是(?)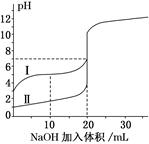
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL 时,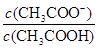 >1
>1
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-)
参考答案:B
本题解析:醋酸是弱电解质,0.100 mol/L的盐酸和醋酸,后者的pH大,有纵坐标判断A不正确;V(NaOH)=10.00 mL 时,溶液中的溶质CH3COOH和CH3COONa,不考虑水解和电离时,二者的物质的量比为1∶1,相同温度和浓度时,CH3COOH的电离大于CH3COO-的水解,B正确;pH=7时,盐酸所用NaOH溶液的体积大,C不正确;V(NaOH)=20 .00 mL 时,两溶液中的溶质分别是NaCl和CH3COONa,且二者的物质的量相等,考虑CH3COO-水解,故c(Cl-)>c(CH3COO-),D不正确。
本题难度:一般
2、选择题 下列各溶液中,pH最大的是(?)
A.pH=9的氨水稀释1 000倍
B.pH=9的烧碱溶液稀释1 000倍
C.pH=5的盐酸稀释1 000倍
D.pH=5的氯化铵溶液稀释1 000倍
参考答案:A
本题解析:C、D两项无论怎么变化pH也不会超过7;pH相同的强碱和弱碱,当稀释相同倍数时,强碱的pH变化大些,弱碱的pH变化要小些,所以A项符合题意。
本题难度:一般
3、选择题 常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是
A.x=y
B.x >y
C.x=10-2y
D.x=102y
参考答案:
本题解析:常温下,pH=6的盐酸由水电离出的c(H+)为10-8,pH=6的NH4Cl溶液由水电离出的c(H+)为10-6,因此,x与y的关系是x=10-2y。
点评:pH相同的强酸和强酸弱碱盐,其原始浓度强酸弱碱盐要大于强酸的浓度。
本题难度:简单
4、选择题 有下列四种溶液①0.01mol/L的H2S溶液;②0.01mol/L的NaHS溶液;③0.02mol/L的HCl与0.04mol/L的NaHS溶液等体积混合液;④0.02mol/L的NaOH与0.02mol/L的NaHS溶液等体积混合液;下列有关微粒浓度大小比较错误的是
A.c(H+)由大到小的顺序是:①>③>②>④
B.c(H2S)由大到小的顺序是:③>①>②>④
C.c (S2-)由大到小的顺序是:④>②>③>①
D.c(HS-)由大到小的顺序是:③>④>②>①
参考答案:D
本题解析:略
本题难度:一般
5、选择题 在25℃时,0.4 mol/L的氢氧化钠溶液与0.6 mol/L的盐酸等体积混合(忽略体积的变化),溶液的pH值约为a;在某温度下,KW= 10-12,10mL 0.01 mol/L的氢氧化钠溶液稀释为1L,溶液的pH值约为b,则a、b的值分别为(?)
A.1和8
B.2和8
C.1和10
D.2和10
参考答案:A
本题解析:在25℃时,NaOH+HCl=NaCl+H2O,酸过量C(H+)=(0.6V-0.4V)/2V=0.1molpH=1,所以a=1,在某温度下,KW= 10-12,氢氧化钠溶液显碱性,C(OH-)=0.01*0.01/1=10-4,
C(H+)=10-12/10-4=10-8? PH="8," b=8?故选A
本题难度:简单