时间:2025-06-26 00:34:07
1、填空题 A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出)。
(1)若A是常见金属单质,与B的水溶液反应生成C和D。D、F是气体单质,D在F中燃烧时发出苍白色火焰。则F所对应的元素在周期表位置是?;反应②(在水溶液中进行)的离子方程式为?。
(2)若A、D为短周期元素组成的固体单质,A为金属,D为非金属。且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
①??;④??。
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是?,分子E的结构式是?。
参考答案:(1)第3周期第ⅦA族,2Fe2++Cl2=2Fe3++2Cl-
(2)①2Mg+CO2 2MgO+C(条件不写得1分)
2MgO+C(条件不写得1分)
④C+4HNO3(浓) CO2↑+4NO2↑+2H2O(条件不写得1分)
CO2↑+4NO2↑+2H2O(条件不写得1分)
(3)原子晶体?
本题解析:(1)若A是常见的金属单质,反应①是置换反应,D、F是气态单质,根据框图可知,A与F生成E,C与F也能生成E,因此A只能为Fe,D为H2,F为Cl2,B为HCl,C为FeCl2,E为FeCl3。
(2)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,反应①是置换反应,根据框图可知,A为Mg,D为C,B为CO2,C为MgO,又知③和④两个反应中都有红棕色气体生成,F为HNO3。
(3)若A、D、F都是非金属单质,反应①是置换反应,A、D同主族,根据框图可知,A与F生成E,C与F也能生成E,因此只能是SiO2与C反应,则A是C、B是SiO2、C是CO、D是Si,E是CO2、F是O2。
本题难度:一般
2、简答题 (13分) 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:



 已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
 根据以上信息回答下列问题:
根据以上信息回答下列问题:
 (1)A的分子式为?;
(1)A的分子式为?;
 (2)反应②的化学方程式是?;
(2)反应②的化学方程式是?;
 (3)A的结构简式是?
(3)A的结构简式是?
 ;(4)反应①的化学方程式是?;
;(4)反应①的化学方程式是?;
 (5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为?。
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为?。
参考答案:(13分)
 (1)C4H6O2?(2分)
(1)C4H6O2?(2分)
 (2)CH3CHO+2Cu(OH)2
(2)CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O?(3分)
CH3COOH+Cu2O↓+2H2O?(3分)
 (3)
(3)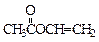 ?(2分)
?(2分)

(4)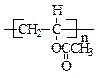 +nH2O
+nH2O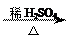
 + nCH3COOH?(3分)
+ nCH3COOH?(3分)
 (5)
(5)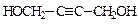 ? (其他合理答案也给分)?(3分)
? (其他合理答案也给分)?(3分)
本题解析:略
本题难度:一般
3、填空题 已知:甲、乙、丙为常见单质,甲常温下为固体,乙为黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为红褐色沉淀,它们之间有下图转化关系。请回答以下问题。 ?
?
(1)写出下列物质的化学式;乙?;B?。
(2)写出③反应的化学方程式:?。
(3)写出②反应的离子方程式:?。
参考答案:
(1)Cl2、FeCl2 (2)? 4Fe(OH)2+2H2O+O2= 4Fe(OH)3 (3) 2Fe3++Fe = 3Fe2+
本题解析:略
本题难度:简单
4、填空题 (13分)中学常见物质A~L的转化关系如下图:(无关产物已略去)
①A、B、H均为单质,A、B有金属光泽,A可以在常温下溶于L的浓溶液,H为黄色固体,向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气。
②D、E、F、I、L都是无色溶液,G是无色气体。
③K是一种白色沉淀,J是一种黄色沉淀,将G通入E后可以产生一种黑色沉淀和L。
(1)写出下列物质的名称:
A??B??H?
(2)A和F也可以反应生成D,写出此化学反应方程式?。
(3)写出试题中出现的几种沉淀的化学式:白色沉淀?;黄色沉淀?;黑色沉淀?。
(4)写出电解E溶液的电极反应式?阳极:?;阴极:?。
参考答案:(1)锌 碘 硫? (共3分)
(2)Zn+2HI=ZnI2+H2↑ (3分)
(3)Zn(OH)2?AgI? Ag2S?(共3分)
(4)4OH--4e-=2H2O+O2↑ Ag++e-="4Ag?" (共4分)
本题解析:根据“向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气”可知Zn 与I2在H2O为催化剂下反应生成ZnI2(D),又因H为黄色固体,可知H为S,再结合题设条件和框图转化可推知G为H2S,F为HI溶液,E为AgNO3溶液,I为Zn(NO3)2溶液、J为AgI沉淀、L为HNO3溶液、K为Zn(OH)2。电解AgNO3溶液时,Ag+在阴极获得电子产生Ag:4Ag++4e-=4Ag,OH―在阳极失去电子产生O2:4OH--4e-=2H2O+O2↑。
本题难度:一般
5、推断题 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰 为黄色,B、C、D是含有A元素的三种 不同化合物,A、B、C、D按下图所示关系进行转化:? 
(1)写出下列物质的化学式: A____;B____;C___;D____。
(2)写出①②③的离子方程式及④的化学方程式: ①____, ②___, ③____, ④____。
参考答案:(1)Na ;NaOH ;Na2CO3 ;NaCl
(2)①2Na+2H2O=2Na++2OH-+H2↑
②2OH-+CO2=CO32- +H2O
③CO32- +2H+=CO2↑+H2O
④2Na +Cl2  2NaCl
2NaCl
本题解析:
本题难度:一般