时间:2025-06-26 00:30:51
1、选择题 NA为阿伏伽德罗常数,下列叙述正确的是
A.18gH2O中含有的质子数为NA
B.常温常压下,Na2O2与足量H2O反应,每生成1 molO2,转移电子的数目为4NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.物质的量浓度为0.5 mol·L-1的MgCl2的溶液中,含有Cl-个数为NA
参考答案:C
本题解析:A、18g水的物质的量是18g/18g/mol=1mol,1个水分子中含有10个质子,所以含有的质子数是10NA,错误;B、Na2O2与足量H2O反应,氧气来自-1价的O元素,所以每生成1 molO2,转移电子的物质的量是2mol,电子数是2NA,错误;C、NO2和N2O4混合气体的平均分子式是NO2,所以46g的混合气体中NO2的物质的量是46g/46g/mol=1mol,所含原子的总数是3NA,正确;D、溶液的体积未知,所以氯离子的数目无法计算,错误,答案选C。
考点:考查阿伏伽德罗常数与粒子数的关系
本题难度:一般
2、选择题 NA表示阿佛加德罗常数,下列说法正确的是
A.1mol 任何气体的体积都约是22.4L
B.18gNH4+含有电子数为10NA
C.NA个H2SO4分子的质量与H3PO4的摩尔质量在数值上相等
D.标准状况下,相同体积的O2、HCl、H2O含有的分子数相同
参考答案:BC
本题解析:A错,缺少标准状况;B正确,gNH4+为10电子粒子;C正确,H2SO4与H3PO4的相对分子质量相等均为98;D错,相同条件下,体积相同的任何气体分子数相等,但水在标准状况下为液体不是气体;
本题难度:一般
3、计算题 欲测定烟雾中的SO2含量,可做下列实验:取100 L该空气(标准状况),通过盛放100 mL过氧化氢(H2O2)水溶液的吸收瓶,使烟雾中的SO2完全吸收,生成硫酸。在反应后的水溶液中加入足量BaCl2溶液,生成白色沉淀,经测定其质量为11.65g(烟雾中其他成分对测定结果无影响)。
(1)写出SO2和H2O2反应的离子方程式。
(2)写出H2SO4与BaCl2反应的离子方程式。
(3)求100 L空气中SO2的体积分数。
参考答案:(1)SO2+H2O2=2H++SO42-(2分)(2)SO42-+Ba2+=BaSO4↓(2分)(3)1.12%(2分)
本题解析:(1)SO2具有还原性,双氧水具有氧化性,二者发生氧化还原反应,反应的离子方程式是SO2+H2O2=2H++SO42-。
(2)稀硫酸和氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式是SO42-+Ba2+=BaSO4↓。
(3)硫酸钡的质量是11.65g,物质的量是11.65g÷233g/mol=0.05mol
因此根据S原子守恒可知,SO2的物质的量也是0.05mol
则100 L空气中SO2的体积分数是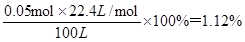 2的性质、空气中SO2含量的测定
2的性质、空气中SO2含量的测定
点评:该题是基础性试题的考查,难度不大,侧重对学生基础知识的巩固,有利于培养学生的逻辑思维能力和规范答题能力。该题的关键是利用好原子守恒,守恒法是化学计算中最常用的方法,需要在平时的学习中注意积累和总结、归纳。
本题难度:一般
4、选择题 已知1.505×1023个X气体分子的质量为8克,则X气 体的摩尔质量为( )
体的摩尔质量为( )
A16克 B 32克 C 64gmol-1 D 32gmol-1
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列说法正确的是( )
A.摩尔是一种国际基本物理量
B.标准状况下气体摩尔体积约为22.4L
C.1mol氧气的质量为16g
D.在同温同压下,相同体积的任何气体单质所含分子数相同
参考答案:D
本题解析:
本题难度:一般