时间:2025-06-26 00:25:09
1、实验题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
参考答案:(1)FeS+2H+=Fe2++H2S↑、ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2+ +2H2O
(4)稀硫酸;铁粉(过量);过滤、浓缩结晶、过滤
(5)加热;是;在密闭容器中加热HgS
本题解析:
本题难度:一般
2、简答题 为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: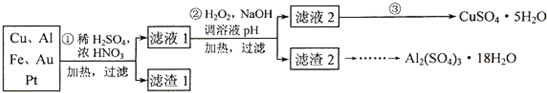
(1)第①步Cu与混酸反应的离子方程式为______.得到滤渣1的主要成分为______.
(2)第②步中加入H2O2的作用是______,使用H2O2的优点是______;调溶液pH的目的是______.
(3)简述第③步由滤液2得到CuSO4?5H2O的方法是______.
(4)由滤渣2制取Al2(SO4)3?18H2O,设计了以下三种方案: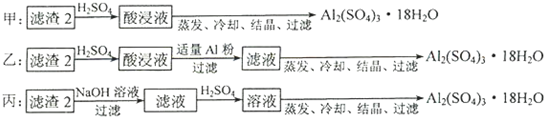
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理.
(5)用滴定法测定CuSO4?5H2O含量.取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
cmol/LEDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:
Cu2++H2Y2-→CuY2-+2H+.写出计算CuSO4?5H2O质量分数的表达式ω=______.
参考答案:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-△.Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-△.3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以是滤渣;
故答案为:Cu+4H++2NO3-△.Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-△.3Cu2++2NO↑+4H2O,Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;使Fe3+、Al3+沉淀除去;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,
甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以从原子利用率和是否产生杂质考虑知,乙更合理,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙.
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol?L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量=cmol/L×b×10-3L=bc×10-3mol;
则ag样品中CuSO4?5H2O的质量=c×b×10-3mol×250g/mol×5,所以CuSO4?5H2O质量分数的表达式=c×b×10-3×250×5a×100%.
故答案为:c×b×10-3×250×5a×100%.
本题解析:
本题难度:一般
3、实验题 某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究.
(1)用下列简图,在方框中画出实验装置(含试剂)示意图.? 
(2)小组经过实验,取得如下数据:? 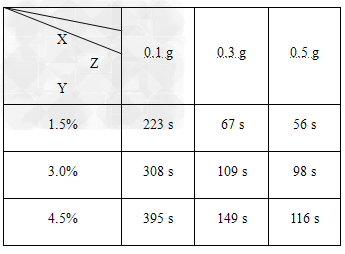
(说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的含量) 分析表中数据回答下列问题:
①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而________.
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择,理由是_____________________.
③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_________________. (提示:可比较相同体积的3.0%与1.5%的双氧水中所含溶质的倍数大小与二者反应结束所用时间的倍数大小作出比较)
参考答案:(1)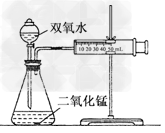 ?
?
(2)①加快
②0.3 ;用0.1?g催化剂的反应速率明显小于用0.3?g和0.5?g催化剂的反应速率,用0.5?g催化剂和用0.3?g催化剂的反应速率及反应时间相差不多,但用0.3?g催化剂节约药品
③不正确 ;从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式(v=Δc/Δt)可得出,此实验条件下双氧水的浓度越大分解速率越快
本题解析:
本题难度:一般
4、选择题 下述实验设计能够达到目的的是(?)
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积的盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉 |
参考答案:B
本题解析:通过导电性比较盐酸和醋酸的酸性强弱,必须使用相同浓度的盐酸和醋酸溶液,A错误。金属钠投入CuCl2溶液中,钠与水反应生成NaOH,NaOH与Cu2+反应生成Cu(OH)2金属钠不能从CuCl2溶液中置换出铜,不能比较金属活动性的强弱,C错误。淀粉只能检验出碘单质,D错误。
本题难度:一般
5、计算题 通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L(在相同条件下测定)。
(1)试确定原混合气体中CO与O2的体积。
(2)若反应后的气体密度在相同条件下为氢气的15倍时,试确定反应气体的组成及体积之比。
参考答案:(1)(A)当两者恰好完全作用时,V(CO)=2(m-n) L V(O2)=(m-n) L;
(B)当CO过量时,过量的CO的体积=m L-[2(m-n) L+(m-n) L]=(3n-2m) L,原混合物中V(O2)=(m-n) L V(CO)=(3n-2m) L+2(m-n) L=n L;
(C)当O2过量时,过量的O2的体积=m L-[2(m-n) L+(m-n) L]=(3n-2m) L;原混合物中V(CO)=2(m-n) L,V(O2)=(3n-2m) L+(m-n) L=(2n-m) L;
(2)CO2与CO的体积比为1∶7。
本题解析:由反应:
2CO + O2====2CO2 ΔV
2? 1? 2? 1
2(m-n)? (m-n)? (m-n)
可知:(A)当两者恰好完全作用时,V(CO)=2(m-n) L
V(O2)=(m-n) L
(B)当CO过量时,过量的CO的体积=m-[2(m-n)+(m-n)]=(3n-2m) L
原混合物中V(O2)=(m-n) L
V(CO)=(3n-2m) L+2(m-n) L=n L
(C)当O2过量时,过量的O2的体积=m L-[2(m-n) L+(m-n) L]=(3n-2m) L
原混合物中V(CO)=2(m-n) L
V(O2)=(3n-2m) L+(m-n) L=(2n-m) L
若反应后的气体密度在相同条件下为氢气的15倍时,混合气体的平均相对分子质量是30,由于产物中肯定有CO2,它的相对分子质量大于30,所以另一种气体的相对分子质量必小于30,另一种气体只能是CO(也就是说O2不可能有余),该混合气体的组成可用下法求得: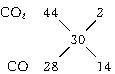
可得V(CO2)∶V(CO)=1∶7
本题难度:简单