时间:2025-06-26 00:22:38
1、简答题 实验室用Na2CO3?10H2O晶体配制250mL0.1mol/LNa2CO3溶液,回答下列问题:
(1)用托盘天平称取Na2CO3?10H2O的质量为______g.
(2)操作中所需仪器除托盘天平、烧杯、玻璃棒外,还需要______(填仪器名称);
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)______;
A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平称量所需的Na2CO3?10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,摇匀
E.改用胶头滴管加水,使溶液凹液面的最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)若出现如下情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①没有进行A操作______;
②称量时,Na2CO3?10H2O已失去部分结晶水______;
③若定容时俯视刻度线______;
④定容摇匀时,发现液面下降,又加水至刻度线______;
⑤容量瓶用蒸馏水洗净后没有干燥______.
参考答案:(1)需要Na2CO3?10H2O的物质的量是:0.250L×0.1mol/L=0.025mol,质量为:0.025×286=7.15g,用托盘天平称取质量是7.2g,
故答案是:7.2;
(2)配制一定浓度的溶液需要的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶等,
故答案是:250mL容量瓶;胶头滴管;
(3)配制步骤是:计算、称量、容积、冷却、转移、洗涤、定容,所以正确的操作顺序是B、C、A、F、E、D,
故答案是:B、C、A、F、E、D;
(4)①配制溶液时必须相同,否则配制的溶液中溶质的物质的量减小,浓度偏低,
故答案是:偏低;
②由于晶体失去结晶水,称取的溶质的质量变大,溶质的物质的量变大,浓度偏高,
故答案是:偏高;
③进行定容时,若是俯视刻度线,导致配制的溶液体积偏小,浓度偏高,
故答案是:偏高;
④定容摇匀时,发现液面下降,又加水至刻度线,导致配制的溶液体积偏大,浓度偏低,
故答案是:偏低;
⑤容量瓶用蒸馏水洗净后没有干燥,不会影响配制结果,
故答案是:无影响.
本题解析:
本题难度:一般
2、选择题 在标准状况下,将A气体V L (摩尔质量是M g·mol-1)溶于0.5 L水中,所得溶液的密度为a g·cm-3,则此溶液的物质的量浓度为(mol·L -1)
A.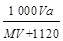
B.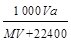
C.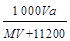
D.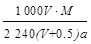
参考答案:C
本题解析:溶质的物质的量是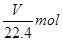 ,而溶液的体积是
,而溶液的体积是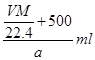 。根据c=n/V可知,选项C正确,答案选C。
。根据c=n/V可知,选项C正确,答案选C。
本题难度:一般
3、计算题 (10分)将足量铁投入到200mLH2SO4与CuSO4的混合溶液中,充分反应后产生H21.12L(STP下),铁块质量减轻1.2g,求原溶液中c(H2SO4)及c(CuSO4)(假设反应前后溶液体积不变)。
参考答案:0.25mol/L? 1.0mol/L
本题解析:考查物质的量的有关计算。主要是依据几个关系式即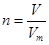 、
、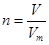 、n=m/M、c=n/V等。
、n=m/M、c=n/V等。
氢气在标准状况下的体积是1.12L
所以依据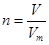 可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol
可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol
根据氢原子守恒可知
原硫酸的物质的量是0.05mol
因此根据c=n/V可知
硫酸的物质的量浓度是0.05mol÷0.2L=0.25mol/L
铁和硫酸铜反应的方程式是
Fe?+? CuSO4=FeSO4+Cu
1mol? 1mol? 1mol
X?x? x
置换出氢气消耗的铁是0.05mol
所以有(x+0.05mol)×56g/mol-64xg/mol=1.2g
解得x=0.2mol
所以硫酸铜的浓度是0.2mol÷0.2L=1.0mol/L
本题难度:一般
4、选择题 在标准状况下,容积为1 L的密闭容器中刚好可以盛放a个N2分子和b个H2分子组成的混合气体,则阿伏加德罗常数的近似值可以表示为()
A.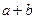
B.22.4(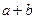 )
)
C.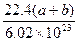
D.22.4(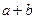 b)×6.02×10
b)×6.02×10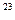
参考答案:B
本题解析:标准状况下,1 L混合气体的分子数为(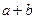 ),那么22.4 L(即1 mol)混合气体的分子数为:22.4×(
),那么22.4 L(即1 mol)混合气体的分子数为:22.4×(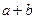 ),即
),即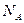 的近似数值。
的近似数值。
另解:标准状况下: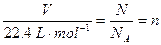 ,
,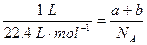
则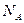 =22.4(
=22.4(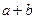 )
) 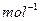
本题难度:简单
5、选择题 设NA为阿伏加德罗常数,下列说法正确的是(? )
A.常温常压下,1.6 g O2和O3混合气体中原子总数为0.1NA
B.标准状况下,过氧化钠与水反应生成1.12 L氧气时转移电子数目为0.2NA
C.0.1 mol·L的CH3COONa溶液中CH3COOH和CH3COO-总数为0.1NA
D.常温常压下,4 g He中,含有的原子数为2NA
参考答案:A
本题解析:A:混合气体中均为O原子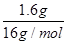 ="0.1" mol;B:2Na2O2+2H2O=4NaOH+O2↑,Na2O2发生了自身氧化还原反应,每生成1mol氧气有2mol电子的转移,故当有1.12 L氧气时转移电子数目为0.1NA;C:溶液体积未指明,无法计算出离子的量;D:氦为单原子分子,4 g He也就是1 mol,原子数也为1 mol
="0.1" mol;B:2Na2O2+2H2O=4NaOH+O2↑,Na2O2发生了自身氧化还原反应,每生成1mol氧气有2mol电子的转移,故当有1.12 L氧气时转移电子数目为0.1NA;C:溶液体积未指明,无法计算出离子的量;D:氦为单原子分子,4 g He也就是1 mol,原子数也为1 mol
本题难度:一般