时间:2025-06-26 00:13:45
1、选择题 将A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g) 2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物B浓度的减少来表示该反应的速率为(?)
2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物B浓度的减少来表示该反应的速率为(?)
A.0.025 mol·L-1·s-1
B.0.012 5 mol·L-1·s-1
C.0.05 mol·L-1·s-1
D.0.1 mol·L-1·s-1
参考答案:B
本题解析:Δn(B)=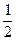 Δn(C)=
Δn(C)= 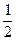 ×0.2 mol="0.1" mol,
×0.2 mol="0.1" mol,
v(B)=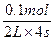 ?="0.0125" mol·L-1·s-1。
?="0.0125" mol·L-1·s-1。
本题难度:简单
2、选择题 在可逆反应中,改变下列条件一定能加快反应速率的是(?)。
A.增大反应物的量
B.升高温度
C.增大压强
D.使用催化剂
参考答案:B
本题解析:在影响反应速率的因素,只要升高温度,反应速率就一定是加快的,而压强、浓度、催化剂则是不一定加快反应速率,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,旨在答题的灵活性。侧重对学生的能力的培养,该题的关键是明确浓度和压强对反应速率影响的适用范围,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 在密闭容器中进行合成氨的反应,达到平衡后,将体系中各物质的浓度增大到原来的2倍,则产生的结果是
A.平衡向正反应方向移动
B.平衡向逆反应方向移动
C.平衡不移动
D.NH3的百分含量增加
参考答案:AD
本题解析:试题分析:达到平衡后,将体系中各物质的浓度增大到原来的2倍,相当于是将容器的容积缩小到原来的2倍,即相当于是加压,因此平衡向正反应方向移动,生成物的百分含量增加,答案选AD。
考点:考查外界条件对平衡状态的影响
点评:本题是基础性试题的考查,难度不大。主要是训练灵活运用知识的能力,有利于调动学生的学习积极性和学习兴趣。
本题难度:一般
4、选择题 在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2mol?L-1降到0.8mol?L-1需要20s,那么反应物浓度再由0.8mol?L-1降到0.2mol?L-1所需要的时间为( )
A.10s
B.大于10s
C.小于10s
D.无法判断
参考答案:反应物的浓度由2mol/L降到0.8mol/L时的平均反应速率V=△C△t=2mol/L-0.8mol/L20s=0.06mol/(L?s),假设以0.06mol/L.s的反应速率计算反应物A的浓度由0.8mol/L降到0.2mol/L所需反应时间t=△CV=0.8mol/L-0.2mol/L0.06mol/(L?s)=10s,实际上A物质的化学反应速率是随着物质浓度的减小而减小,所以反应物的浓度由0.8mol/L降到0.2mol/L时的平均反应速率小于0.06mol/L.s,所以所用时间应大于10s;
故选:B;
本题解析:
本题难度:简单
5、填空题 (14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)?△H=-802 kJ·mol-1
则CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= ? kJ·mol-1
2CO(g)+2H2(g) △H= ? kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应
CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
①据图可知,p1、p2、 p3、p4由大到小的顺序 ? 。
②在压强为p4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为?。该温度下,反应的平衡常数为?。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是?
A.体系压强不再变化
B.H2与CO的物质的量之比为1:1
C.混合气体的密度保持不变
D.气体平均相对分子质量为15,且保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向?(填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在右图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
参考答案:(14分,每空2分)
(1) +248?
(2) ①p4>p3>p2>p1?
②0.032mol·L-1·min-1? 1.64?
(3) ① AC?② 逆?变化曲线见右图 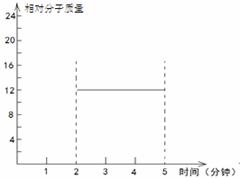
本题解析:(1)已知
①2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)?△H3=-802 kJ·mol-1
根据盖斯定律,③-②-①得:CH4(g)+CO2(g) 2CO(g)+2H2(g),故△H=△H3-△H2-△H1=-802 kJ·mol-1+484 kJ·mol-1+566 kJ·mol-1=+248kJ·mol-1。(2)①反应CH4(g)+CO2(g)
2CO(g)+2H2(g),故△H=△H3-△H2-△H1=-802 kJ·mol-1+484 kJ·mol-1+566 kJ·mol-1=+248kJ·mol-1。(2)①反应CH4(g)+CO2(g) 2CO(g)+2H2(g)为气体分子数增加的反应,当温度一定时,减小压强,可增大CH4的转化率,从图像可知,相同温度下,按p4、p3、p2、p1的顺序CH4的转化率增大,所以p4>p3>p2>p1。②根据X点CH4的转化率求得各物质的平衡浓度分别为:c(CH4)= c(CO2)=0.02mol·L-1,c(CO)= c(H2)=0.16mol·L-1,
2CO(g)+2H2(g)为气体分子数增加的反应,当温度一定时,减小压强,可增大CH4的转化率,从图像可知,相同温度下,按p4、p3、p2、p1的顺序CH4的转化率增大,所以p4>p3>p2>p1。②根据X点CH4的转化率求得各物质的平衡浓度分别为:c(CH4)= c(CO2)=0.02mol·L-1,c(CO)= c(H2)=0.16mol·L-1,
故v (CO) = 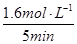 ?= 0.032mol·L-1·min-1;K =
?= 0.032mol·L-1·min-1;K = 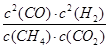 ?=
?= 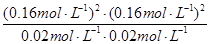 ?= 1.64(mol·L-1)2(通常不必写单位)。(3)①A项,恒容条件下,随着反应的进行,气体的物质的量增加,压强增大,若体系压强不变,说明达到了平衡状态;B项,从反应物出发建立平衡,则生成的CO和H2的物质的量总是相等的,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;C项,随着反应的进行,气体的质量增加,而体积不变,所以密度增大,当气体密度不变时,可以认定达到了平衡状态;D项,只有当反应完全生成CO和H2时,气体平均相对分子质量才能等于15,但一定条件下的可逆反应是不能进行完全的,所以不会出现D项所描述的状态。②加压时,平衡向着气体分子数减小的方向即逆反应方向移动;平衡气体的平均相对分子质量为M =
?= 1.64(mol·L-1)2(通常不必写单位)。(3)①A项,恒容条件下,随着反应的进行,气体的物质的量增加,压强增大,若体系压强不变,说明达到了平衡状态;B项,从反应物出发建立平衡,则生成的CO和H2的物质的量总是相等的,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;C项,随着反应的进行,气体的质量增加,而体积不变,所以密度增大,当气体密度不变时,可以认定达到了平衡状态;D项,只有当反应完全生成CO和H2时,气体平均相对分子质量才能等于15,但一定条件下的可逆反应是不能进行完全的,所以不会出现D项所描述的状态。②加压时,平衡向着气体分子数减小的方向即逆反应方向移动;平衡气体的平均相对分子质量为M = 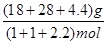 ?= 12g·mol-1,从化学方程式可看出,当正(逆)向平衡移动时,气体的质量变化增加(减少)12g,而气体的物质的量相应增加(减少)1mol,所以混合气体的相对分子质量并不发生变化,即M恒定为12g·mol-1。
?= 12g·mol-1,从化学方程式可看出,当正(逆)向平衡移动时,气体的质量变化增加(减少)12g,而气体的物质的量相应增加(减少)1mol,所以混合气体的相对分子质量并不发生变化,即M恒定为12g·mol-1。
本题难度:一般