时间:2025-06-26 00:06:19
1、简答题 如图是A~O的转化关系.已知A、F是金属单质,B、C、D、E、H、I、J、K常温常压下均为气体,且B、C、D、E是单质,I是一种红棕色气体,G是一种淡黄色固体,M的水溶液遇硫氰化钾溶液显红色,J与K相遇会产生大量白烟.请回答下列问题:
(1)A为______,C为______,F为______;(均填名称)
(2)写出气体E与N溶液反应的离子方程式______
(3)写出L与N溶液加热反应的化学方程式______.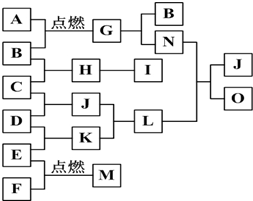
参考答案:A是金属单质,B是气体,A和B在点燃条件下反应生成G,G是一种淡黄色固体,G是金属化合物为Na2O2,A是Na,B是O2,I是一种红棕色气体,则I是NO2,H为气体,一氧化氮被氧化生成二氧化氮,所以H是NO,C是气体,且C是单质,则C是N2,J与K相遇会产生大量白烟,氯化氢和氨气相遇产生白烟氯化铵,则L是NH4Cl,根据元素守恒知,J为NH3,K是HCl,则D是H2,E是Cl2,F是金属单质,M的水溶液遇硫氰化钾溶液显红色,则M是FeCl3,过氧化钠和水或二氧化碳反应都生成氧气,N和氯化铵反应生成氨气,则N且强碱,所以过氧化钠和水反应生成氢氧化钠和氧气,则N是NaOH,由N+L→J+O知,O为NaCl,
(1)通过以上分析知,A是钠,C是氮气,F是铁,故答案为:钠;氮气;铁;
(2)E是氯气,N是氢氧化钠,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)L是氯化铵,N是氢氧化钠,加热条件下,氯化铵和氢氧化钠反应生成氨气、氯化钠和水,反应方程式为:NH4Cl+NaOH△.NaCl+NH3↑+H2O,
故答案为:NH4Cl+NaOH△.NaCl+NH3↑+H2O.
本题解析:
本题难度:简单
2、推断题 A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素。 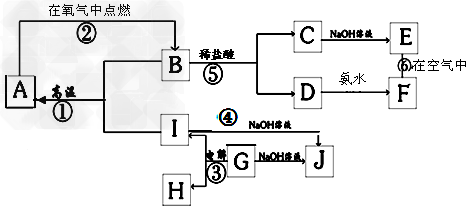
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是_______。
(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)?_________________。
(3)写出下列反应的化学方程式或离子方程式:反应①的化学方程式:______________;反应④的离子方程式:__________________;反应⑥的化学方程式:____________________________?;
(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是_______(填序号)。
参考答案:(1)第4周期Ⅷ族
(2)取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+?
(3)8Al+3Fe3O4 4Al2O3+9Fe;2Al+2OH-+6H2O?=2[Al(OH)4]-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3?
4Al2O3+9Fe;2Al+2OH-+6H2O?=2[Al(OH)4]-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3?
(4)①②
本题解析:
本题难度:一般
3、推断题 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。?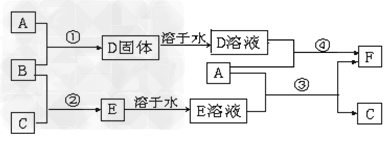
?请回答:
(1)写出B物质的化学式:_________;F的名称:__________。
(2)写出第③步反应的化学方程式为?___________。
(3)第④步反应中溶液颜色的变化____________;
(4)F溶液中滴入NaOH溶液可能产生的实验现象是______________。
参考答案:(1)Cl2?;氯化亚铁
(2)Fe?+2HCl?=?FeCl2?+?H2↑?
(3)溶液由黄色变为浅绿色,2Fe3+ +?Fe?=3Fe2+?
(4)先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
本题解析:
本题难度:一般
4、填空题 (11分)由短周期元素组成的10种物质A~J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答: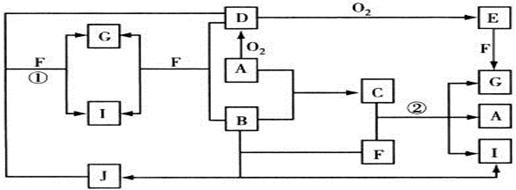
(1)写出下列物质的化学式:B_________,E__________,F的结构式__________。
(2)反应①的离子方程式为______________________________;
(3)足量铁与G的热的浓溶液反应所得气体是?;
铁与B反应的化学方程式?。
(4)C是一种重要的化工产品,为易挥发的樱桃红色液体。若反应②中生成的G、A和I的物质的量之比1︰2︰6,则C的电子式为?,反应②的化学方程式为__??。
参考答案:(1)Cl2;SO3;H—O—H(每空1分,共3分)
(2)HClO+SO2+H2O=3H++SO42-+Cl-(2分)? (3)SO2、H2(2分) (1分)? (4)
(1分)? (4)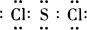 (2分)
(2分)
3SCl2+4H2O=H2SO4+2S↓+6HCl(2分)
本题解析:常见的液体化合物是水,根据转化关系图可知A应该是固体非金属单质,A的最高价氧化物对应的水化物又可以和A反应生成水,所以A水S,D是SO2,E是SO3,G是H2SO4。A、B为同周期相邻元素的单质,且B是气体,所以B是氯气。氯气溶于水生成HCl和HClO,HClO光照分解即得到HCl,所以J是HClO,I是HCl。HClO和氯气均具有氧化性,可以氧化SO2生成硫酸,而自身被还原生成HCl。C是氯和硫构成的化合物,该化合物溶于水生成硫酸、单质硫和HCl。
(1)结构式是用一根短线表示一对孤电子对,所以H2O结构式为H—O—H。
(3)因为铁是过量的,而随着反应的进行,浓硫酸的浓度会降低,当达到一对浓度后,浓硫酸变为稀硫酸,因此会生成氢气。
(4)H2SO4、S、HCl的物质的量之比是1︰2︰6,所以根据原子守恒可知硫原子和氯原子的个数之比是1︰2,因此C的化学式为SCl2,组成元素均是非金属元素,所以是通过共价键形成的共价化合物,电子式为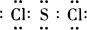 。
。
本题难度:一般
5、推断题 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: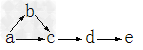
其中:?a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
a_______;b_______;c_______;d________;e________。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a_______;b_______;c_______;d________;e________。
参考答案:(1)硫;硫化氢;二氧化硫;三氧化硫;硫酸
(2)N2;NH3;NO;NO2;HNO3
本题解析:
本题难度:一般