时间:2025-06-26 00:05:32
1、选择题 关于硝酸性质的下列叙述中,不正确的是.
A.硝酸是无色、易挥发、有刺激性气味的液体
B.硝酸不稳定,浓度越大越易分解
C.硝酸与硫化钠反应能产生H2S气体
D.将铁粉与热的浓硝酸混合反应,产物中不一定有Fe(NO3)2
参考答案:C
本题解析:H2S具有强还原性,而HNO3具有强氧化性,两者会发生氧化还原反应.
本题难度:困难
2、选择题 与1mol NH3所含有的分子数目相同的是
A.0.5mol O2
B.1mol Fe
C.2mol H2
D.2mol H2O
参考答案:B
本题解析:只从简单的物质的量上来看,答案为B
注:铁是金属晶体,不是由分子直接组成,故本题没有准确的选项
本题难度:困难
3、选择题 从经济效益和环保考虑,大量制取硝酸铜最宜采用的方法是
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu→CuO→Cu(NO3)2
D.Cu+AgNO3→Cu(NO3)2
参考答案:C
本题解析:分析:从经济角度出发,那么也就是说在制取等量的硝酸铜时,所用的原料是最少的最便宜的成本最低;从环境保护的角度出发,在制取硝酸铜是最好不要对环境造成污染.结合这两个原因可以对选项一一排除.
解答:A、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,HNO3利用率不高,NO2是有毒气体,污染环境,故A错误.
B、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,HNO3利用率不高,NO是有毒气体,污染环境,故B错误.
C、2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O,该反应过程原料的利用率高,没有有毒气体生成,不污染环境,故C正确;
D、Cu+2AgNO3=Cu(NO3)2+2Ag,AgNO3成本较高,同时AgNO3会对环境造成一定的污染,主要是重金属污染,故D错误;
故选:C;
点评:本题考查了学生根据所学的知识来判断如何从环保和经济的角度制取硝酸铜,培养了大家的环保概念和保护和合理使用金属资源的意思.
本题难度:困难
4、选择题 下列方法中,不可以用来鉴别甲烷和乙烯的方法是
A.通入足量溴水中
B.分别进行燃烧
C.通入高锰酸钾溶液中
D.在一定条件下通入氢气
参考答案:D
本题解析:甲烷和乙烯和氢气反应没有明显的现象,而且反应较难.
本题难度:困难
5、选择题 NA为阿伏加德罗常数的值,下列说法正确的是
A.2.3g金属钠变成钠离子时失去的电子数目为0.1NA
B.在常温常压下,11.2L氧气含有的电子数为8NA
C.标准状况下,22.4L单质溴含有的原子数为2NA
D.惰性电极电解饱和食盐水若产生2g H2,则生成的氯气为2mol
参考答案:A
本题解析:分析:A、依据n=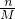 计算物质的量,结合钠原子最外层一个电子计算;
计算物质的量,结合钠原子最外层一个电子计算;
B、依据气体摩尔体积的条件应用是标准状况下的气体分析判断;
C、标准状况溴单质不是气体;
D、电解饱和食盐水生成氢气和氯气物质的量相同;
解答:A、2.3g金属钠物质的量为0.1mol,变成钠离子时失去的电子数目为0.1NA,故A正确;
B、不在标准状况下,11.2L氧气不是0.5mol,故B错误;
C、标准状况溴单质不是气体,22.4L单质溴不是1mol,故C错误;
D、惰性电极电解饱和食盐水,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,若产生2g H2物质的量为1mol,则生成的氯气为1mol,故D错误;
2NaOH+H2↑+Cl2↑,若产生2g H2物质的量为1mol,则生成的氯气为1mol,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常的应用.主要是质量换算物质的量计算微粒数,气体摩尔体积的条件应用,电解原理的计算题目难度中等.
本题难度:困难