时间:2025-06-26 00:03:54
1、选择题 一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g) 2C(g)?经2分钟反应达到平衡,此时生成0.2mol C。
2C(g)?经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是?(?)
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
参考答案:C
本题解析:
解本题学生应明确化学反应速率的基本公式V=△C÷△t 和化学反应速率的表示规律;外在条件对化学平衡移动方向的影响。
知有反应? A(g)+3B(g) 2C(g)
2C(g)
始? 1? 2? 0? mol
2分钟末? 1-0.1? 2-0.3? 0.2? mol
变化? 0.1? 0.3? 0.2? mol
A应为:V(B)=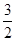 V(C)=
V(C)= 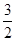 ×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
B应为:2分钟末A的转化率为 = 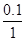
 100% =" 10%"
100% =" 10%"
C:正确。升高温度从图中可见:逆反应速率增大的倍数大于正反应速率增大的倍数,平衡向逆反应方向移动,即逆反应吸热,正反应放热。
D:错误,本反应反应物气体系数和为4,生成物气体系数为2,增大压强平衡向气体体积减小的方向移动。应为,正反应速率增大的倍数大于逆反应速率增大的倍数。
本题难度:简单
2、选择题 可逆反应,C(s)+H2O CO(g)+H2(g);△H>0,下列说法正确的是(? )?
CO(g)+H2(g);△H>0,下列说法正确的是(? )?
A.达到平衡时,反应物的浓度和生成物的浓度相等
B.达到平衡时,反应物和生成物的浓度不随时间的变化而变化
C.由于反应前后分子数相等,所以增加压力对平衡没有影响
D.加入正催化剂可以加快反应达到平衡的速度
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (3分)在相同容积的4个容器中进行同一种可逆反应,2A2(g)+ B2(g) 5C(g),起始时4个容器所盛A2和B2的量如下表所示:
5C(g),起始时4个容器所盛A2和B2的量如下表所示:
| 容量 | 甲 | 乙 | 丙 | 丁 |
| A2(mol) | 2 | 1 | 2 | 1 |
| B2(mol) | 1 | 1 | 2 | 2 |
参考答案:丁>乙>丙>甲
本题解析:根据反应物的物质的量可知,甲相当于是在乙的基础上增加A2的物质的量,所以A2的转化率小于乙中A2的转化率;丙相当于在乙的基础上增大压强,平衡向逆反应方向进行,转化率降低;而丙相当于在丁的基础上增加A2的物质的量,所以A2的转化率小于丁中A2的转化率;丁相当于在乙的基础上增加B2的物质的量,所以A2的转化率大于乙中A2的转化率;又因为丙相当于在甲的基础上增加B2的物质的量,所以A2的转化率大于甲中A2的转化率,则4个容器中A2的转化率由大到小的顺序是丁>乙>丙>甲。
本题难度:一般
4、选择题 已知反应mA(g)+nB(g) qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
A.增加A的质量,B的转化率降低
B.降低温度,混合气体的平均相对分子质量变小
C.通入稀有气体压强增大,平衡向正反应方向移动
D.B的正反应速率是A的逆反应速率的n/m
参考答案:D
本题解析:A是气体,增加A的质量,则平衡向正反应方向移动,B的转化率增大,A不正确;正反应是放热反应,所以降低温度,平衡向正反应方向移动。又因为正反应是体积减小的,所以混合气体的平均相对分子质量变大,B不正确;通入稀有气体压强增大,但物质的浓度不变,平衡不移动,C不正确;根据反应速率在之比是相应的化学计量数之比可知,D正确,答案选D。
本题难度:一般
5、选择题 在一定条件下,对于密闭容器中进行的可逆反应:
N2(g)+3H2(g  ?2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是(?)?
?2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是(?)?
A.N2、H2、NH3在密闭容器中共存
B.N2、H2、NH3的浓度相等
C.N2、H2、NH3的浓度不再变化
D.反应停止,正、逆反应速率都等于零
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以C正确,D不正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,B不正确。可逆反应中反应物和生成物是同时存在的,A不正确,答案选C。
本题难度:一般