时间:2025-06-26 00:02:15
1、选择题 简单原子的原子结构可用如图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述错误的是( )
A.①②③属同种元素
B.①②③互为同位素
C.①②③为碳元素的三种核素
D.①②③是三种化学性质不同的粒子
参考答案:D
本题解析:
本题难度:一般
2、选择题 有关化学用语正确的是( )
A.乙烯的最简式C2H4
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式
D.硫离子的核外电子排布式1s22s22p63s23p6
参考答案:A、乙烯的最简式CH2,故A错误.
B、乙醇的结构简式为CH3CH2OH,故B错误.
C、四氯化碳的电子式为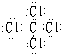
,故C错误.
D、乙酸的分子式C2H4O2S的原子序数为16,根据能量最低原理判断其电子排布式为1s22s22p63s23p4,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素原子的电子层结构时,X放出的能量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z.则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是( )
A.Z2X
B.Z2Y
C.W2X
D.W2Y
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列电子排布式中,原子处于激发状态的是
[? ]
A.1s22s22p5
B.1s22s22p43s2
C.1s22s22p63s23p63d44s2
D.1s22s22p63s23p63d34s2
参考答案:BC
本题解析:
本题难度:简单
5、填空题 核电荷数小于18的2种元素A、B,A原子最外层电子数为a,次外层电子数为b;B元素原子M层电子数为a-b,L层电子数为a+b.则元素A是______元素,B是______元素.
参考答案:根据A、B2种元素的核电荷数小于18知,这两种元素的原子序数小于18;A原子最外层电子数为a,次外层电子数为b;最外层电子数小于等于8,所以a大于0,小于8或等于8;次外层为K层或L层,所以b为2或8.
B元素原子M层电子数为a-b,L层电子数为a+b,所以8≥a-b>0.a+b=8,
所以由以上分析得a、b满足以下条件,
?0<a≤8,a-b>0,a+b=8,8≥a-b>0. b=2或8
所以a、b分别为:
? a=6? b=2
所以A的原子核外有8(2+6=8)个电子,是O元素;
B的原子核外有14(2+8+4=14)个电子,是Si元素.
故答案为:氧? 硅
本题解析:
本题难度:一般