时间:2025-06-26 00:00:35
1、选择题 下列实验用来证明SO2的存在,其中正确的是(?)
A.能使品红褪色。
B.能使湿润的蓝色石蕊试纸变红。
C.通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸。
D.通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。
参考答案:D
本题解析:具有漂泊性的物质不止二氧化硫一种,A不能证明。酸性气体都可以使湿润的蓝色石蕊试纸变红,B不能证明。选项C中也可以是CO2,所以也不能证明。通入稀溴水中能使溴水褪色,得澄清溶液,说明该气体具有还原性。再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸,则说明沉淀是硫酸钡,所以气体是二氧化硫,因此正确的答案是D。
本题难度:一般
2、选择题 已知向品红溶液中加入稀硫酸,溶液颜色加深。现将SO2缓慢通入稀品红溶液中,观察到的现象是(?)
A.红色先加深后褪至无色
B.红色立刻褪去,溶液变为无色
C.红色加深,颜色不褪
D.红色既不加深也不褪去
参考答案:A
本题解析:SO2通入品红溶液中使其褪色,这一结论同学们可谓烂熟于胸,但根据题给信息,当品红溶液的pH减小时,溶液的红色会加深,因此本题考查的内容有两点:一是SO2缓慢通入稀品红溶液中时先发生如下反应:SO2+H2O 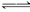 ?H2SO3,亚硫酸的生成和电离使溶液的pH减小,故溶液的红色应先加深;二是当SO2达到足够大的浓度时,与品红溶液生成不稳定的无色物质而表现红色褪去。
?H2SO3,亚硫酸的生成和电离使溶液的pH减小,故溶液的红色应先加深;二是当SO2达到足够大的浓度时,与品红溶液生成不稳定的无色物质而表现红色褪去。
本题难度:简单
3、实验题 (11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为:?︰?;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是?,除去这种杂质的实验操作称为?。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16,? Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是?;
A.CuCl2
B.NaOH
C.Cu2(OH)2CO3
D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式?。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是?;
⑤写出该反应的化学方程式为?。
参考答案:(1)3∶2 (1分)?(2)Cu(NO3)2 (1分)?重结晶(1分)
(3)坩埚(1分)?①3? (1分)?②CD(1分)
③2Fe3++Cu==2Fe2++Cu2+(2分)
④防止双氧水分解(1分)?
⑤Cu+H2O2+H2SO4=CuSO4+2H2O(2分)
本题解析:(1)得到1mol硫酸铜需要转移2mol电子,根据得失电子守恒可知,需要硝酸2/3mol,理论上硫酸和硝酸的物质的量之比最佳为3︰2。
(2)因为反应中硝酸不可能完全被还原,所以有可能存在硝酸铜,可通过重结晶来除杂。
(3)铜是固体,灼烧需放在坩埚中。当铁离子的浓度等于10-5mol·L-1时,根据[Fe((OH)3]≈10-38可得出OH-的浓度为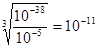 mol/L,所以其pH至少应为3。甲物质是用来调节溶液的酸碱性的,又因为不能引入新的杂质,所以选择CD。双氧水不稳定,易分解,且温度越高,越易分解。
mol/L,所以其pH至少应为3。甲物质是用来调节溶液的酸碱性的,又因为不能引入新的杂质,所以选择CD。双氧水不稳定,易分解,且温度越高,越易分解。
本题难度:一般
4、实验题 实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。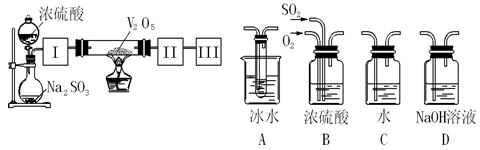
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为?。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ?,装置Ⅱ?,装置Ⅲ?。
(3)开始进行实验时,首先应进行的操作是?。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会?(填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是?。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是?(用含字母的代数表示)。
参考答案:(1)2SO2(g)+O2(g) 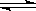 ?2SO3(g);△H=-196.6 kJ/mol (2分)
?2SO3(g);△H=-196.6 kJ/mol (2分)
或 SO2(g)+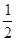 O2(g)
O2(g) 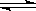 ?SO3(g);△H=-98.3 kJ/mol
?SO3(g);△H=-98.3 kJ/mol
(2) B, A, D (3分)
(3)检查装置的气密性(1分)
(4)减小(1分)
(5)继续通入氧气一段时间(1分)
(6)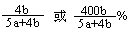 (2分)
(2分)
本题解析:(1)ΔH与反应物的物质的量有关,所以热化学方程式中各物质的系数必须与ΔH相对应,如果系数加倍,则ΔH也要加倍。?
(2)图中Ⅰ装置的作用一是干燥气体;二是使SO2和O2均匀混合,所以选B、Ⅱ装置的作用是冷却SO3,使其变成液体,所以选A,、Ⅲ装置的作用除去尾气SO2,所以选D (3分)?
(3)一般说来,无论采用那种装置制取气体,在成套装置组装完毕装入反应物之前,必须检查装置的气密性,以确保实验的顺利进行。(1分)
(4)因为2SO2(g)+O2(g) 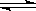 ?2SO3(g)是放热反应,升高温度,向逆向移动,所以转化率减小。(1分)
?2SO3(g)是放热反应,升高温度,向逆向移动,所以转化率减小。(1分)
(5)继续通入氧气,可以使残留在装置中的SO2、SO3随着氧气流一起流动,最终全部被NaOH吸收。 (1分)
(6)实验结束后,若装置Ⅱ增加的质量为反应生成的SO3的质量,,装置Ⅲ增加的质量为末反应的SO2的质量,所以根据化学方程式,设反应的SO2质量为x;
2SO2(g)+O2(g) 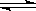 ?2SO3(g)
?2SO3(g)
128? 160
x? b
x= b
b
所以二氧化硫的转化率为 b/(a+
b/(a+ b)=
b)=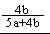 (2分)
(2分)
本题难度:困难
5、选择题 向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是…( )
A.浓H2SO4具有脱水性
B.浓H2SO4具有吸水性
C.盐酸具有挥发性
D.气体溶质的溶解度随温度升高而降低
参考答案:A
本题解析:浓硫酸的脱水性是指浓硫酸把有机物的H、O两元素按原子个数比2:1的比例脱出来,形成水分子。而吸水性是指吸收现成的水分子,包括水蒸汽、湿存水和结晶水
本题难度:简单