时间:2025-06-26 00:00:35
1、选择题 研究发现,空气中少量的NO2能作为催化剂参与硫酸型酸雨的形成,NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是
A.硫化氢通入浓H2SO4中
B.稀H2SO4和乙酸乙酯共热
C.浓H2SO4和C2H5OH共热到170℃
D.潮湿的氯气通过盛有浓H2SO4的洗气瓶
参考答案:
 B
B
本题解析:选项A中浓硫酸是氧化剂,B中是催化剂,C中是催化剂和脱水剂,D中是吸水剂,因此正确的答案选B。
本题难度:简单
2、选择题 下列化合物不能由单质间直接化合生成的是( )?
A.Cu2S
B.Fe2S3
C.HgS
D.Fe3O4?
参考答案:B
本题解析:S氧化性弱,不能将Fe、Cu氧化到+3、+2价,Cu2S能由单质化合生成,Fe2S3不能。Hg虽有变价,但S可将Hg氧化到+2价。Fe3O4是Fe在氧气中燃烧的产物。
本题难度:简单
3、选择题 由于温室效应等环境问题不断被重视,气象台天气预报普遍增加了“空气质量日报”,下列不属于“空气质量日报”范围的是
A.悬浮颗粒
B.氮氧化物
C.二氧化碳
D.二氧化硫
参考答案:C
本题解析:分析:“城市空气质量日报”报道内容主要为污染性物质的含量,其中硫氧化物、氮氧化物以及粉尘等.
解答:A.悬浮颗粒危害人体的呼吸道,属于有害物质,属于“城市空气质量日报”报道的物质,故A不选;
B.氮氧化物为有害气体,属于“城市空气质量日报”报道的物质,故B不选;
C.二氧化碳无毒,不属于“城市空气质量日报”报道的物质,故C选;
D.二氧化硫为有害气体,属于“城市空气质量日报”报道的物质,故D不选;
故选C.
点评:本题考查常见生活环境的污染问题,题目较为基础,学习中注意相关基础知识的积累.
本题难度:困难
4、填空题 研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有?。(填写字母编号)
A.温室效应
B.酸雨
C.粉尘污染
D.水体富营养化
将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为?。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为?。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下: ?工业生产中,步骤③的反应条件为?。
?工业生产中,步骤③的反应条件为?。
该工艺中物质D可以作为原料循环利用,它的化学式为?。
写出步骤②反应的离子方程式?。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式?。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_?。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应 ?
NO + NO2 + Na2CO3 = 2NaNO2 + CO2?
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2?
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为?。
参考答案:(1)ABC(2分?漏选扣1分)
Ca(HCO3)2或碳酸氢钙
Ca(HSO3)2+O2=CaSO4+H2SO4
(2)点燃? NaCl? SO2+OH—= HSO3—
(3)3NO2+H2O=2HNO3+NO
2NO+2CO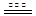 N2+2CO2
N2+2CO2
(4)4.48L(4分)
本题解析:(1)SO2引起酸雨 、CO2能引起温室效应、PM2.5粉尘污染等故答案选择ABC。被氧化的方程式为Ca(HSO3)2+O2=CaSO4+H2SO4?工业生产盐酸的反应条件为点燃,亚硫酸氢钠和盐酸反应生成了氯化钠和二氧化硫。步骤②反应的离子方程式SO2+OH—= HSO3—。
(3)NO2转化为HNO3的化学方程式3NO2+H2O=2HNO3+NO。根据题信息,写出NO被CO还原的化学方程式2NO+2CO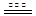 N2+2CO2。(4)NO和NO2的混合气体8.96L物质的量为0.4mol,又混合气体中NO和NO2的体积比为1:3,则NO,NO2分别为0.1mol,0.3mol。根据已知方程式NO + NO2 + Na2CO3 = 2NaNO2 + CO2,NO2还剩下0.2mol,发生了第二个反应 2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2生成了二氧化碳0.1mol,故吸收过程中产生气体在标准状况下的体积为4.48L。
N2+2CO2。(4)NO和NO2的混合气体8.96L物质的量为0.4mol,又混合气体中NO和NO2的体积比为1:3,则NO,NO2分别为0.1mol,0.3mol。根据已知方程式NO + NO2 + Na2CO3 = 2NaNO2 + CO2,NO2还剩下0.2mol,发生了第二个反应 2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2生成了二氧化碳0.1mol,故吸收过程中产生气体在标准状况下的体积为4.48L。
本题难度:一般
5、推断题 (15分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: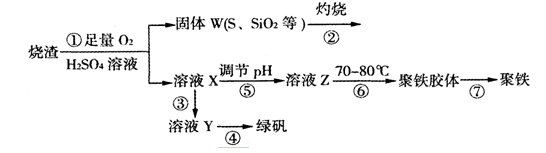
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是?;
A.品红溶液?B.紫色石蕊溶液? C.酸性KMnO4溶液?D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:?;
(3)过程③中,需加入的物质是?;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有?;
(5)过程⑤调节pH可选用下列试剂中的?(填选项序号);
A.稀硫酸? B.CaCO3? C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是?;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为?。(假设杂质中不含铁元素和硫元素)。
参考答案:(1)ACD ?(2)4FeS+3O2 + 12H+= 4Fe3++6H2O+4S (3)Fe(或铁)?(4)蒸发皿、玻璃棒?
(5)C(6)促进Fe3+的水解?(7)31.1%
本题解析:(1)固体W中含有S、SiO2,将其灼烧。其中的S会变为SO2气体,SO2气体有漂白性,能使品红溶液褪色,SO2气体有还原性,能使酸性KMnO4溶液或溴水因发生氧化反应反应而褪色,但是使紫色石蕊试液变为红色。因此选项为A、C、D。(2)过程①中,根据框图中的各种物质及质量守恒定律和电子守恒、电荷守恒可知:FeS和O2、H2SO4反应的离子方程式为4FeS+3O2 + 12H+= 4Fe3++6H2O+4S。(3)由于发生反应得到的物质中含有Fe3+.,而最后要制取绿矾FeSO4,所以过程③中,要加入还原剂Fe粉。(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒。(5)过程⑤调节pH,使溶液的pH增大,应该加入碱,排除A,而若加入CaCO3,会消耗酸,但是引入的杂质离子Ca2+不容易除去,因此可选用下列试剂中的NaOH。选项为C。(6)过程⑥中,将溶液Z加热到70一80℃,目的是促进Fe3+的水解使迅速产生聚铁。(7)n(SO42-)=3.495g÷233g/mol=0.015mol。n(Fe)= n(SO42-)= 0.015mol,所以m(Fe)=0.015mol×56g/mol=0.84g,所以该聚铁样品中铁元素的质量分数为(0.84g÷ 2.700g)×100%=31.1%。2的性质、离子方程式的书写、化学实验基本操作及元素的质量分数的计算的知识。
本题难度:一般