时间:2025-06-25 23:53:14
1、填空题 (14分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的?极,材料是?,该极上出现的现象是?,写出该电极的反应式?。
(2)a可能为?
A、铜? B、银? C、铁 D、石墨
(3)c溶液是?
A、CuSO4溶液? B、AgNO3溶液? C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为?克。
参考答案:(1)负、Cu、铜片逐渐溶解,溶液变蓝色、Cu – 2e-? =? Cu2+
(2) BD?(3)B?(4)21.6
本题解析:由Cu+2Ag+ =2 Ag +Cu2+知,铜失电子,Cu – 2e-? =? Cu2+,做负极,不断溶解。正极材料应为比铜活性差的电极。
本题难度:简单
2、选择题 下列关于甲、乙、丙、丁四幅图说法正确的是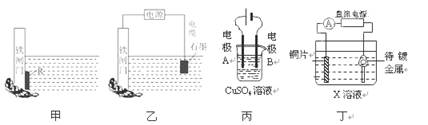
A.装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R可以是锡块
B.装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连
C.装置丙可实现电解精炼铜,电极A的材料用纯铜,电极B的材料用粗铜
D.装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液
参考答案:B
本题解析:铁的活泼性强于锡的,A不正确,应该用锌快;C不正确,粗铜精炼时,粗铜做阳极,和电源的正极相连;D不正确,X溶液应用含有镀层金属阳离子的溶液,答案选B。
点评:该题是电化学的综合应用,试题基础性强,难度不大。该题的关键是明确电化学的原理,然后结合题意灵活运用即可,有助于培养学生的逻辑思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、选择题 若按下图甲装置进行实验,图乙中x、y分别表示流入电极的电子、某产物的物质的量。若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液,电解过程中溶液的pH随时间t变化的示意图如丙所示。则下列叙述中正确的是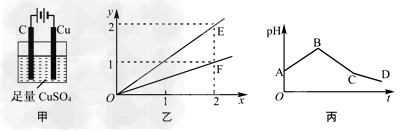
[? ]
A.E表示反应生成Cu的物质的量?
B.F表示反应生成H2SO4
C.BC段阳极产物是Cl2?
D.CD段电解的物质是NaCl
参考答案:B
本题解析:
本题难度:一般
4、填空题 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。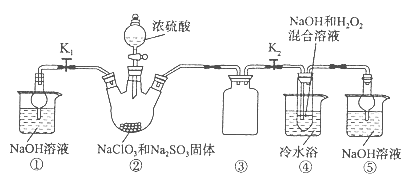
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:??。
(2)装置②中产生ClO2的化学方程式为 ?。
装置④中发生反应的离子方程式为??。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②?;③?;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。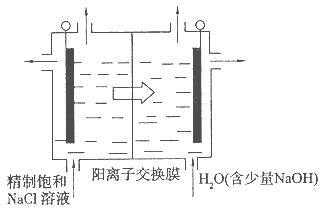
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 ?。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为?mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是?;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为?。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为?。
参考答案:(1)关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合理答案均得分)
(2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2↑;
(3)趁热过滤;用38℃~60℃温水洗涤;
(4)Cl--5e-+2H2O=ClO2↑+4H+;0.01mol;
(5)溶液由蓝色变为无色且半分钟内不变色;90.5%。
本题解析:(1)组装好仪器后,检查整套装置气密性的操作是:关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合理答案均得分)(2)装置②中产生ClO2的反应是氯酸钠、亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化氯和水,化学方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;根据题意知,装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2、H2O和O2,离子方程式为2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2↑;(3)从溶液中得晶体一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2?3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,答案为:趁热过滤;用38℃~60℃温水洗涤;(4)①根据题给装置分析,电解池阳极反应为氯离子失电子生成ClO2,氯元素的化合价由—1价升高到+5价,结合原子守恒和电荷守恒写出,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+②电解池阴极为氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,氢气的物质的量为0.005mol,则放电的氢离子为0.01mol,根据电中性原则通过阳离子交换膜的阳离子为+1价离子的物质的量为0.01mol;(5)根据题意知,配制250mL待测液需用到的定量玻璃仪器是250mL容量瓶;以淀粉溶液做指示剂,碘单质遇淀粉变蓝色,反应结束时,碘反应完全,蓝色褪去,达到滴定终点时的现象为当滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色;根据题给反应ClO2-+4I-+4H+=2H2O+2I2+C1-,I2+2S2O32-=2I-+S4O62-得关系式:NaClO2——4S2O32-,设样品中NaClO2的质量分数为x,则有:
NaClO2——4S2O32-
90.5g?4mol
10xg? 2 mol?L-1×0.02L×10
解得x=90.5%。
本题难度:困难
5、选择题 在铁皮上镀一层锌时,可用如图的装置。以下叙述错误的是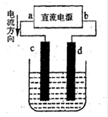
A.电镀前,铁皮可用热碱溶液除油渍,盐酸除铁锈
B.c为铁,d为锌
C.用含Zn2+的盐配成电解质溶液
D.电镀时,发生氧化和还原反应的都是锌元素
参考答案:B
本题解析:A.电镀前,油渍的成份是酯,在碱性条件下易水解,洗净后便于金属附着上去,再用盐酸除铁锈,正确; B.c是阳极,电镀时为镀件铁要做阴极,错误;C.用含Zn2+的盐配成电解质溶液,正确;D.电镀时,发生氧化和还原反应的都是锌元素,正确;
本题难度:一般