时间:2025-06-25 23:49:11
1、选择题 下列离子方程式正确的是
A.氯气通入水中 :Cl?2+H2O=2H++Cl-+ClO-
B.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O
D.向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-= BaCO3↓+CO32-+2H2O
2、选择题 下列反应的离子方程式书写正确的是?(?)
A.浓烧碱溶液中加入铝片:Al + 2OH-=AlO2-+H2↑
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 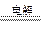 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
3、填空题 (8分)写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)___________________________________________ ___
___
(2)碳酸钠溶液与盐酸混合_________________________ ________________________
________________________
(3)硫酸铜溶液和氢氧化钡溶液混合____________________
(4)向足量澄清石灰水中通入二氧化碳_______________________________
4、选择题 下列对对应现象的描述与离子方程式都正确的是(? )
A.金属镁与稀盐酸反应:有气体生成,Mg+2H++2Cl-=MgCl2+H2↑
B.氯化钡溶液与硫酸反应:有白色沉淀生成:SO42-+Ba2+ =BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2H+=2Na++CO2↑+H2O
D.过量铁粉与氯化铜溶液反应:溶液南蓝色变成浅绿色,同时有红色固体生成:Fe+Cu2+=Fe3++Cu
5、选择题 下列离子方程式正确的是:
A.0.75mol氯气通入含有1mol溴化亚铁溶液中:
3Cl2 + 2Fe2+ +4Br-="=" 6Cl-+ 2Fe3+ + 2 Br2
B.在溶液中NH4HSO3与NaOH等物质的量混合:
NH4+ + HSO3-+2OH-="=" SO32-+2 H2O+NH3↑
C.过量CO2通入NaAlO2溶液中:
CO2 + 2 H2O + AlO2- === Al(OH)3↓+ CO32-
D.向双氧水中加入酸性的高锰酸钾溶液:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O