时间:2025-06-25 23:41:00
1、填空题 (10分)如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D.Y.H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
请回答下列问题:
(1)用电子式表示X的形成过程:____________________。
(2)写出D.H.X反应生成A的离子反应方程式:____________________。
(3)已知:2H(g)+Y(g)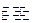 2I(g);
2I(g); 。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
A.40%? B.50%? C.80%? D.90%
(4)标准状况下在1000mL某密闭容器中装有440mL的C溶液,向其中加入3.9g Na2O2充分反应后恢复至原温度,发现容器内气体压强变为原来的1.5倍(忽略溶液体积变化),则原C溶液的物质的量浓度为__________mo1·L-1。(保留两位有效数字)
参考答案:(1)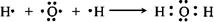 ?(2分)
?(2分)
(2)SO2+NH3+H2O=NH4++HSO3-(2分)
(3)D?(3分)
(4)0.057?(3分)
本题解析:略
本题难度:一般
2、填空题 常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):
已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是______;化合物丙中存在的作用力:______.
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是______.
③烧杯中溶液由无色变为红色,其原因______.(用电离方程式解释)
参考答案:根据图示信息可知,化合物丙是氯化铵,甲和乙是氯化氢和氨气中的一种,因为氨气是氮气和氢气化合而成的,氯化氢是氢气和氯气化合而成的,所以Y一定是氢气,X分子中含共价键最多,所以X是氮气,Z是氯气,甲是氨气,乙是氯化氢.
(1)氮气的结构式为:N≡N,氯化铵是离子晶体,其中的作用力是离子键,故答案为:N≡N;离子键;
(2)①氨气易溶于水,密度比空气小,用向下排空气法来收集,装置图为: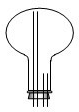
,故答案为:
;
②实验室中有氯化铵和氢氧化钙固体反应生成氨气的方法来制取氨气,发生的化学反应方程式是:2NH4Cl+Ca(OH)2?△?.?2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2?△?.?2NH3↑+2H2O+CaCl2;
③氨气溶于水形成的氨水显碱性,能使酚酞显红色,因为NH3?H2O=NH4++OH-,故答案为:NH3?H2O=NH4++OH-.
本题解析:
本题难度:简单
3、填空题 现有X、Y、Z三种元素,已知X元素的单质和燃烧时和氧气反应生成X2O2,在空气中X2O2可吸收二氧化碳生成碳酸盐并放出氧气,其碳酸盐分子内各原子的质子数总和为52;Y单质0.45g与盐酸完全反应,可生成YCl3和标准状况的氢气560mL.Y元素的核内有14个中子;元素Z的气态氢化物为H2Z,其+4价的氧化物在标准状况下的密度为2.875g-L-1,Z元素原子核内质子数和中子数相等.
(1)请写出X、Y、Z的元素符号及元素名称:X______,Y______,Z______.
(2)写出X2O2吸收二氧化碳的化学方程式______.
(3)写出Y单质与盐酸反应的离子方程式______.
参考答案:现有X、Y、Z三种元素,已知X元素的单质燃烧时和氧气反应生成X2O2,在空气中X2O2可吸收二氧化碳生成碳酸盐并放出氧气,其碳酸盐分子内各原子的质子数总和为52,则X为钠元素;Y单质0.45g与盐酸完全反应,可生成YCl3和标准状况的氢气560mL,Y为金属,令Y的摩尔质量为Mg/mol,则0.45gMg/mol×3=0.56L22.4L/mol×2,解得M=27.Y元素的核内有14个中子,所以Y的质子数为27-14=13,故Y为铝元素;元素Z的气态氢化物为H2Z,其+4价的氧化物为ZO2,在标准状况下的密度为2.875g?L-1,ZO2相对分子质量为2.875×22.4=64,所以Z元素的相对原子质量为32,Z元素原子核内质子数和中子数相等,则Z元素质子数为16,故Z为硫元素.
故X为钠元素;Y为铝元素;Z为硫元素.
(1)由上述分析可知,X为钠元素,元素符号为Na;Y为铝元素,元素符号为Al;Z为硫元素,元素符号为S.
故答案为:钠、Na;铝、Al;硫、S.
(2)X2O2为Na2O2,过氧化钠与二氧化碳反应生成碳酸钠和氧气,Na2O2吸收二氧化碳的化学方程式为
2Na2O2+2CO2=2Na2CO3+O2↑.
故答案为:2Na2O2+2CO2=2Na2CO3+O2↑.
(3)Al单质与盐酸反应生成氯化铝和氢气,反应的离子方程式为2Al+6H+=2Al3++3H2↑.
故答案为:2Al+6H+=2Al3++3H2↑.
本题解析:
本题难度:一般
4、实验题 (1)下图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀。
①写出B→C的化学方程式
?
②写出B→A的化学方程式
?
③C→F的离子方程式?
④E→D的离子方程式?
⑤上图中共发生了8个反应(每根箭头一个反应),其中有?个是氧化还原反应;从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强?
(2)把某黑色固体单质A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X ,将X做如下图所示的实验:
①由此可以推断:A为?;C为??和 ?
②写出D加入F生成E和G的离子方程式?
③C通入澄清石灰水时,若气体通过量则白色沉淀又会溶解,写出白色沉淀溶解的化学方程式?
?
参考答案:(1)①H2O+H2SO3+Cl2=2HCl+H2SO4 (2分)②2H2S+H2SO3=3S+3H2O (2分) ③Ba2++SO42-=BaSO4↓(2分)
④BaSO3+2H+=SO2↑+Ba2++H2O(2分)?⑤(2分)3;H2S+ Cl2=S+2HCl(2分)
(2)①碳(2分);二氧化碳和一氧化氮(2分)?
②3Cu+2NO3-+8H+=3Cu2++4H2O+2NO↑ (2分)
③CaCO3+CO2+H2O=Ca(HCO3)2(2分)
本题解析:略
本题难度:一般
5、简答题 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B的电子式:A______、B______、C、D的化学式C______、D______.
(2)写出A离子与B反应的离子方程式:______.
参考答案:(1)A、B是10电子离子,C、D是10电子分子,发生反应A+B=C+D,A、B、C、D均含有两种元素,判断为:A、B分别为OH-、NH4+,C、D分别为NH3、H2O,AB的电子式为:
OH-离子电子式: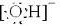
,NH4+电子式为
,故答案为: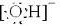
;
;NH3;H2O;
(2)A离子与B反应的离子方程式:OH-+NH4+=NH3↑+H2O,故答案为:OH-+NH4+=NH3↑+H2O.
本题解析:
本题难度:一般