时间:2025-06-25 23:41:00
1、填空题 A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系:
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀。写出下列过程的离子方程式:
①B的水溶液呈酸性____________。 ②C→D_______________。 ?③E→C________________。
(2)若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。?
①A的电子式为__________。?
②电解D的水溶液时,反应的离子方程式为________________。
③生铁浸入D溶液而发生锈蚀,正极的电极反应为________________。?
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的 =1012。
=1012。
①B→C的化学方程式为:?。
②A→C的反应中,每转移1 mol e-就会吸热45 kJ,写出该反应的热化学方程式:?。
参考答案:(1)①Al3++3H2O  ?Al(OH)3+3H+;?②AlO2-+H++H2O=Al(OH)3↓?③Al2O3+2OH-=2AlO2-+H2O
?Al(OH)3+3H+;?②AlO2-+H++H2O=Al(OH)3↓?③Al2O3+2OH-=2AlO2-+H2O
(2)①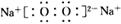 ; ?②2Cl-+2H2O
; ?②2Cl-+2H2O H2↑+Cl2↑+2OH-;?③O2+4e-+2H2O=4OH-
H2↑+Cl2↑+2OH-;?③O2+4e-+2H2O=4OH-
(3)①4NH3+5O2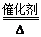 4NO+6H2O?②N2(g)+O2(g)=2NO(g)?△H="+180" kJ/mol
4NO+6H2O?②N2(g)+O2(g)=2NO(g)?△H="+180" kJ/mol
本题解析:(1)根据题意可推知:A:Al ;? B:AlCl3;? C:NaAlO2; D:Al(OH)3;? E:Al2O3.①B的水溶液呈酸性是因为AlCl3是强酸弱碱盐,弱碱根离子水解消耗了水电离产生的OH-,最终当溶液达到平衡时,C(H+)>C(OH-).水解的离子方程式为:Al3++3H2O  Al(OH)3+3H+ ②C→D AlO2-+H++H2O=Al(OH)3↓③E→C? Al2O3+2OH-=2AlO2-+H2O
Al(OH)3+3H+ ②C→D AlO2-+H++H2O=Al(OH)3↓③E→C? Al2O3+2OH-=2AlO2-+H2O
(2) 若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。?则个物质分别是:A :Na2O2; B :NaOH; C :Na2CO3;D : NaCl;E :NaHCO3. ①Na2O2的电子式为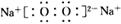 .②电解饱和NaCl的水溶液的离子方程式为2Cl-+2H2O
.②电解饱和NaCl的水溶液的离子方程式为2Cl-+2H2O H2↑+Cl2↑+2OH-;③生铁浸入NaCl溶液而发生的是吸氧腐蚀,正极的电极反应为O2+4e-+2H2O=4OH-,正极的电极式为Fe-2e-=Fe2+.
H2↑+Cl2↑+2OH-;③生铁浸入NaCl溶液而发生的是吸氧腐蚀,正极的电极反应为O2+4e-+2H2O=4OH-,正极的电极式为Fe-2e-=Fe2+.
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的 =1012。则A:N2;B:NH3;C:NO;D:NO2;E:HNO3。①B→C的化学方程式为:4NH3+5O2
=1012。则A:N2;B:NH3;C:NO;D:NO2;E:HNO3。①B→C的化学方程式为:4NH3+5O2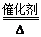 4NO+6H2O②A→C的反应的热化学方程为:N2(g)+O2(g)=2NO(g)?△H="+180" kJ/mol。
4NO+6H2O②A→C的反应的热化学方程为:N2(g)+O2(g)=2NO(g)?△H="+180" kJ/mol。
本题难度:困难
2、填空题 X、Y是短周期同主族元素,Z是过渡元素,化合物Z2X、Z2Y可发生如下转化。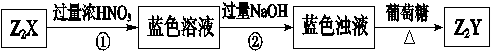
(1)X的元素符号为_______,Z2Y的化学式为_______。
(2)蓝色溶液中含有的阴离子是?。
(3)过程②中发生反应的离子方程式为?。
参考答案:
(1)S?Cu2O
(2)NO3-、SO42-、OH-
(3)H++OH-=H2O?Cu2++2OH-=Cu(OH)2↓
本题解析:突破口为由蓝色溶液和蓝色浊液,及与葡萄糖反应推出Z2Y为Cu2O,又因X、Y是短周期同主族元素,则X为硫元素,Z2X为Cu2S。浓硝酸有强氧化性将Cu2S氧化为Cu2+和SO42-。
本题难度:一般
3、简答题 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
请回答问题.
(1)物质A的化学式是______.
(2)检验E溶液中的金属离子,常选用的试剂是______(填化学式).
(3)溶液B与气体F反应的离子方程式是______.
(4)物质C转化为物质D的反应中伴随的主要现象是______,化学方程式是______.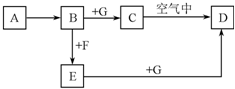
参考答案:由转化关系可知A应为变价金属,应为Fe,F为有毒气体,应为Cl2,则B应为FeCl2,E为FeCl3,C为Fe(OH)2,D为Fe(OH)3,
(1)由以上分析可知A为Fe,故答案为:Fe;
(2)检验Fe3+,可用KSCN,溶液呈红色,故答案为:KSCN;
(3)溶液B与气体F反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-;,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)Fe(OH)2不稳定,易于空气中氧气发生反应生成Fe(OH)3,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最终变成红褐色,
故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
本题解析:
本题难度:一般
4、简答题 如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C各1mol.X.E.G的焰色反应均为黄色.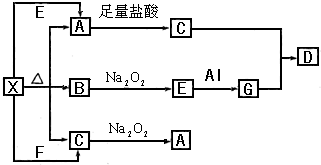
回答下列问题:
(1)写出下列物质的化学式:A.______
(2)写出X受热的化学反应方程式:______
(3)写出X+E→A的离子方程式:______
(4)写出C与Na2O2参加反应的化学方程式______,若0.2molNa2O2参加反应,则转移的电子数为______个.
参考答案:X、E、G的焰色反应均为黄色,都含有Na元素;
X分解生成无色液体B,故B为H2O,BNa2O2
本题解析:
本题难度:一般
5、简答题 X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:
已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色.请回答:
(1)Y和X浓溶液反应的条件是______,而常温下难反应的原因是______.
(2)写出F和G相互转化的化学方程式:F→G+X______G→F______
(3)L转化成I的现象是______,有关的化学方程式是______.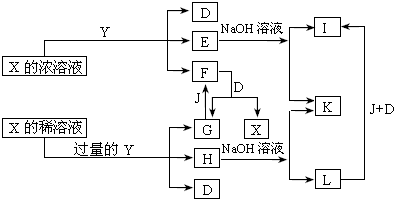
参考答案:X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色,说明E含有Fe3+离子,加入氢氧化钠溶液生成氢氧化铁沉淀I为Fe(OH)3,L为Fe(OH)2,H为含Fe2+离子的溶液;K为推断Y为Fe,D为H2O,J为O2,依据Y和X的浓溶液反应生成的F和D反应生成G和X,判断F为NO2,X为HNO3,G为NO,所以推断出E为Fe(NO3)3,H为Fe(NO3)2,依据推断得到的物质分别为:X为HNO3,Y为Fe;D为H2O,Fe(NO3)3,H为Fe(NO3)2,F为NO2,G为NO,J为O2,K为NaNO3,L为
Fe(OH)2,I为Fe(OH)3;
(1)Y和X浓溶液反应的条件是加热,常温下铁在浓硝酸中 发生钝化现象;
故答案为:加热,Fe表面被浓硝酸钝化;
(2)依据分析推断得到F→G+X反应的化学方程式为:3NO2+H2O=2HNO3+NO,G→F反应的化学方程式为:2NO+O2=2NO2
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2
(3)L转化成I是氢氧化亚铁被一氧化为氢氧化铁,反应的现象是:白色固体迅速变为灰绿色,最后变为红褐色,有关的化学方程式是?4Fe(OH)2+2H2O+O2=4Fe(OH)3;
故答案为:白色固体迅速变为灰绿色,最后变为红褐色; 4Fe(OH)2+2H2O+O2=4Fe(OH)3;
本题解析:
本题难度:一般