时间:2025-06-25 23:38:32
1、选择题 同一周期的两主族元素A、B能形成AB2型离子化合物,A、B元素在周期表中的族序数可能为( )
A.ⅡA、ⅦA
B.IA、ⅦA
C.ⅣA、ⅥA
D.IA、VA
参考答案:由同一周期的两主族元素A、B能形成AB2型离子化合物,
则A为+2价,A在元素周期表中的第ⅡA族,
B为-1价,其最高价为+7价,则B在元素周期表中的第ⅤⅡA族,
故选A.
本题解析:
本题难度:简单
2、选择题 两种非金属元素A、B所形成的下列分子中属于非极性分子的是
[? ]
A. 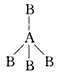
B. 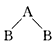
C. 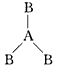
D. 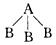
参考答案:AC
本题解析:
本题难度:简单
3、选择题 短周期的A、B两种元素,A原子半径小于B的原子半径,两种元素可形成A是正价的AB2型化合物.下列关于两元素的叙述正确的是( )
①A、B可能属于同一周期②A是B的前一周期元素;
③A只能是金属元素;?④A可能是第二周期IIA族或IVA族元素.
A.①③
B.②③
C.②④
D.②③④
参考答案:C
本题解析:
本题难度:一般
4、选择题 M元素的一个原子失去2个电子,这2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中,正确的是( )
A.Z的电子式为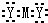
B.Z可表示为M2Y
C.Z一定溶于水中
D.M形成+2价阳离子
参考答案:D
本题解析:
本题难度:简单
5、填空题 (6分)下列各组物质① O2和O3② H2、D2、T2?③12C和14C
④ CH3CH2CH2CH3和 (CH3)2CHCH3?⑤乙烷(C2H6)和丁烷(C4H10)?
互为同分异构体的是______?_______ ,?互为同位素的是____?__,?互为同素异形体的是________?__。
参考答案:④;③;①;
本题解析:同分异构体指的是分子式相同结构不同的物质,同位素指的是同种元素形成的不同核素,同素异形体指的是同种元素构成的不同单质。
本题难度:一般