时间:2025-06-25 23:37:43
1、实验题 (共9分)某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案?。
(2)学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因?。
(3)学生内另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法?
(Ⅱ)学生丁设计了下图装置以验证氮、碳、硅元素的非金属性强弱。他设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
(1)A写出所选用物质的化学式:
A:?,
B:?。
(2)写出烧杯中发生反应的离子方程式:?。
参考答案:
(Ⅰ)(1)方案二(1分)
(2)未除去镁表面的氧化膜(2分)
(3)取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH),溶解,而Mg(OH)2则不溶。(2分)
(Ⅱ)、(1)HNO3;CaCO3(2分)
(2)CO2+SiO32-+H2O=H2SiO3↓+CO32-
或:2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-?(2分)
本题解析:略
本题难度:简单
2、填空题 X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| ? | X | Y | Z | M | R | Q |
| 原子半径/nm | ? | ? | 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合价 | ? | -4,+4 | ? | -2 | -1,+7 | +3 |
| 其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 | ? | ? | ? |
参考答案:(6 分)(1)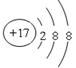 ;同位素(2)O2、 O3? (注:本整小题合计共2分,错一个不给分。) ?(3)2Na+2H2O=2NaOH+H2↑(2分)
;同位素(2)O2、 O3? (注:本整小题合计共2分,错一个不给分。) ?(3)2Na+2H2O=2NaOH+H2↑(2分)
本题解析:X元素阳离子核外无电子,这说明X应该是氢元素。Y的主要化合价是-4和+4价,且可做半导体材料,因此Y是硅元素。焰色反应呈黄色,则Z是钠元素。R的主要化合价是-1价和+7价,所以R是氯元素。M的化合价是-2价,且原子半径小于氯元素,因此M是氧元素。Q的原子半径大于氯元素,小于钠元素的,且化合价是+3价,所以Q是铝元素。
点评:该题是高考中的常见考点,属于基础性试题的考查。试题基础性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理和规范答题能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
3、选择题 两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是? ①a=b+3;? ②a+b=8;? ③a+b="30" ;? ④a=b+8
A.②③
B.③④
C.②③④
D.①②③④
参考答案:C
本题解析:略
本题难度:一般
4、选择题 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:X>Y
D.X、Z形成的化合物中可能含有共价键
参考答案:D
本题解析:由题给关系图,推出X为O,Y为F,Z为Na,R为S,W为Cl。A选项,O和S不在同一周期,错误;B选项,同一周期从左到右原子半径依次减小,一般情况下电子层数多的元素半径大,S>Cl>O,错误;C选项,非金属性越强,气态氢化物越稳定,HF>H2O,错误;D选项,X、Z形成的Na2O2含有共价键,正确。
本题难度:一般
5、选择题 下列常用的混合物分离或提纯操作中,需使用冷凝器的是
A.过滤
B.蒸发
C.蒸馏
D.分液
参考答案:C
本题解析:A. 过滤需要的仪器是铁架台、漏斗、烧杯、玻璃棒
B. 蒸发需要的仪器是三脚架,蒸发皿、酒精灯、玻璃棒
C?蒸馏,我们需要收集馏分,所以需要冷凝器,选C
D. 分液需要的主要仪器是分液漏斗。
本题难度:简单