时间:2025-06-25 23:36:56
1、选择题 在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用
[? ]
A.NaOH
B.HCl
C.NaCl
D.CuSO4
参考答案:A
本题解析:
本题难度:一般
2、填空题 (16分)某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;
CO2(g) △H=-393kJ?mol-1;
2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;
2CO2(g) △H=-566kJ?mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为 。
(2))将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |

 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。参考答案:(1)(2分)C(s)+H2O(g)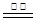 CO(g)+H2(g) △H=+132kJ?mol-1
CO(g)+H2(g) △H=+132kJ?mol-1
(2)①放热(2分) ②0.8mol/(L·min) (2分)
③20%((2分) ④加催化剂(2分) [画曲线见右图] 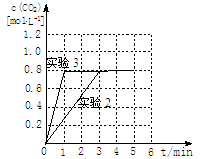 (2分)
(2分)
(3)(2分)4OH--4e-=O2↑+2H2O
(4)(2分)CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3
本题解析:(1)已知:①C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g)
CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g)
2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g)  CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min);③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min);③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
考点:考查热化学方程式书写、盖斯定律,化学反应速率和化学平衡,电极反应式、化学方程式的书写。
本题难度:困难
3、填空题 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g
10.00%的K2SO4溶液,电极均为石墨电极。 
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题:
① 电源的N端为___________极;
② 电极b上发生的电极反应为___________;
③ 列式计算电极b上生成的气体在标准状况下的体积:___________;
④ 电极c的质量变化是___________g;
⑤ 电解前后个溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液____________________;乙溶液___________________;丙溶液______________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?____________________________________________。
参考答案:(1)①正极;②4OH--4e-==2H2O+O2↑;③2.8L;④16g;⑤甲增大,因为相当于电解水;乙减小,OH-
放电,H+增多;丙不变,相当于电解水
(2)可以,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
本题解析:
本题难度:一般
4、选择题 用惰性电极电解NaCl和CuSO4混合液250 mL,经过一段时间后,两极均得到11.2 L气体(标准状况下),则下列有关描述中,正确的是(?)
A.阳极发生的反应只有:4OH--4e-=2H2O+O2↑
B.两极得到的气体均为混合气体
C.若Cu2+起始浓度为1 mol·L-1,则c(Cl-)起始为 2 mol·L-1
D.Cu2+的起始物质的量应大于0.5 mol
参考答案:C
本题解析:阳极一开始是Cl-放电,然后OH-放电,A错;根据放电顺序,在阴极,一开始Cu2+放电,不产生气体,后来只有H+放电产生0.5 mol H2,B错;若Cu2+起始浓度为1 mol·L-1,则阴极共通过1.5 mol e-,阳极生成11.2 L气体(标准状况下),转移1.5 mol e-,设氯气的物质的量为x,氧气的物质的量为y,则x+y="0.5" mol,2x+4y="1.5" mol,解得,x="y=0.25" mol,C对;根据极限思维,若阳极产生的0.5 mol气体全是氧气会转移2 mol e-,因有氯气产生,故转移的电子小于2 mol,阴极产生的氢气转移电子1 mol,故产生铜的过程中转移电子小于1 mol,故Cu2+的起始物质的量应小于0.5 mol,D错。
本题难度:一般
5、选择题 在25℃时,用铂电极电解一定量的Na2SO4饱和溶液,一段时间后,阳极析出amol气体,同时溶液中析出bg Na2SO4·10H2O,如果在这一过程中温度不变,则此时Na2SO4溶液中溶质的质量分数为(?)
A.(71/161)×100℅
B.〔71b/161(18a+b)〕×100℅
C.〔b/(18a+b)〕×100℅
D.〔71b/161(36a+b)〕×100℅
参考答案:B
本题解析:略
本题难度:简单