时间:2025-06-25 23:22:08
1、选择题 下列事实不能用电化学理论解释的是
[? ]
A.轮船水线下船壳上装有一定数量的锌块
B.铝片不用特殊方法保存
C.纯锌与稀H2SO4反应时,滴入少量的硫酸铜溶液后反应速率加快
D.镀锌铁比镀锡铁耐用
参考答案:B
本题解析:
本题难度:一般
2、填空题 (6分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g) CH3OH(g)ΔH="-129.0" kJ·mol-1
CH3OH(g)ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 _____________。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程: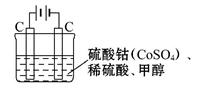
①写出阳极电极反应式 _______ 。
②写出Co3+除去甲醇的离子方程式 。
参考答案:(6分) (1) CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)①Co2+ — e-  Co3+ ②6Co3++CH3OH+H2O
Co3+ ②6Co3++CH3OH+H2O CO2↑+6Co2++6H+
CO2↑+6Co2++6H+
本题解析:(1)根据盖斯定律,I+II可得所求的热化学方程式,所以CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1;
CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1;
(2)①阳极发生氧化反应,则Co2+ 被氧化成Co3+,电极反应式为Co2+ — e-  Co3+;
Co3+;
②Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化,本身又被还原为Co2+,所以Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O CO2↑+6Co2++6H+。
CO2↑+6Co2++6H+。
考点:考查离子方程式的书写,盖斯定律的应用
本题难度:一般
3、选择题 银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是
A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶解于食盐水生成了AgCl
D.铝质容器为阳极,其质量变轻
参考答案:B
本题解析:A该处理过程是构成了原电池装置,是把化学能转化为电能,AD都错误;B.由于铝比较活泼,做负极,银器为正极,Ag2S还原为单质银,正确;C.Ag2S在食盐水中溶解,错误;
本题难度:一般
4、计算题 I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。
参考答案:(16分)
I.2ΔH1-2ΔH2+ΔH3(3分)
II.(1)其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动。(或描述降温的变化,3分)
(2)如下图(2分)(形状1分,标注1分)
(3)计算过程为:(格式2分,速率1分,常数2分,共5分)
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L)0.8 0.8 0.8 2.4
平衡浓度(mol/L)0.2 0.2 0.8 2.4


(平衡常数没写单位不扣分)
III.O2 + 2H2O + 4e-=4OH-(3分)
本题解析:I.先将4个热化学方程式依次编号为①②③④,再观察、比较后可得:①×2—②×2+③=④,由盖斯定律可知,④的焓变=①的焓变×2—②的焓变×2+③的焓变=2ΔH1-2ΔH2+ΔH3;II.(1)先读图1,发现在1Mpa或2Mpa、600℃~1000℃时,随着温度的升高,甲烷平衡含量均逐渐减小,说明平衡向正反应方向移动;再根据温度对化学反应速率和化学平衡的影响规律,当其他条件不变时,升高温度,反应速率加快,平衡向吸热反应方向或正反应方向移动,则甲烷蒸气转化为氢气的正反应是吸热反应;(2)画图要点:①甲烷蒸气转化为氢气的正反应是气体体积增大的反应,当温度和水碳比保持不变时,增大压强,平衡向气体体积减小方向或逆反应方向移动,则甲烷平衡含量增大,因此2MPa时甲烷平衡含量与水碳比之间关系曲线一定高于1MPa时甲烷平衡含量与水碳比之间关系曲线;②当温度和压强保持不变时,随着水碳比的增大,甲烷平衡含量逐渐减小;(3)依题意可知该可逆反应中各组分起始、变化、平衡浓度,则:
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 2.4
平衡浓度(mol/L) 0.2 0.2 0.8 2.4
根据平均反应速率的定义式,v(H2)= =
= =0.4mol/(L?min)
=0.4mol/(L?min)
根据化学平衡常数的定义式,K= =
= mol2/L2≈276.5 mol2/L2
mol2/L2≈276.5 mol2/L2
III.甲醇燃料电池中正极的主要反应物为氧气,氧元素由0降为—2价,则1个氧气分子得到4个电子,在KOH溶液中只能用氢氧根离子使反应物和产物的电荷守恒,则O2+4e-→4OH-;左边比右边少4个H、2个O原子,根据氢、氧原子个数守恒可知反应物中还有2H2O,则正极反应式为O2 +4e-+2H2O =4OH-。
考点:考查化学反应原理,涉及根据盖斯定律求焓变、根据化学平衡图像得出温度对反应速率和平衡移动的影响规律、根据压强对化学平衡的影响规律画出图像、根据各组分(起始、变化、平衡)浓度模型法计算平均反应速率和平衡常数、碱性甲醇-空气燃料电池的正极反应式等。
本题难度:困难
5、选择题 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH4-+ 8OH-+8e-→BO2-+ 6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
参考答案:B
本题解析:A.通入硼氢化合物NaBH4的电极为负极,通入H2O2的电极为正极。A.电池放电时Na+会移向负电荷较多的正极。即从a极区移向b极区。错误。B.电极b采用MnO2,MnO2是H2O2分解产生氧气的催化剂。因此MnO2既作电极材料又有催化作用。正确。C.该电池的负极反应为:BH4-+ 8OH--8e-→BO2-+ 6H2O。错误。D.根据电子转移数目相等可知:每消耗3 mol H2O2,转移的电子为6 mol.错误。4和H2O2作原料的燃料电池的工作原理的知识。
本题难度:一般