时间:2025-06-25 23:20:35
1、计算题 实验室需要0.5mol/L的硫酸500mL,若使用溶质的质量分数为98%(密度为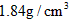 )的浓硫酸进行配制。求:
)的浓硫酸进行配制。求:
(1)该浓硫酸的物质的量浓度;
(2)需要浓硫酸的体积。
参考答案:(1)18.4mol/L
(2)13.6mL
本题解析:
本题难度:一般
2、选择题 200mlFe2(SO4)3溶液中含Fe3+56g,溶液中SO42-的物质的量浓度是( )
A.5mol/L
B.7.5?mol/L
C.10?mol/L
D.2.5?mol/L
参考答案:56gFe3+的物质的量为56g56g/mol=1mol,溶液中n(SO42-)=32n(Fe3+)=32×1mol=1.5mol,所以溶液中SO42-的物质的量浓度1.5mol0.2L=7.5mol/L.
故选B.
本题解析:
本题难度:简单
3、填空题 处理含正六价铬的废水样液(+6价Cr的含量为78mg/L)。实验步骤如下:?
①取1L废水加入一定量1.8mol/LH2SO4溶液使样液酸化?
②加入一定量的绿矾(FeSO4·7H2O),将正六价铬转化为正三价铬离子?
③加入过量的石灰水,使正三价铬离子转化为Cr(OH)3沉淀?
④过滤,除去沉淀物?
(1)配制步骤①中所需H2SO4溶液100 mL,需用18 mol/L H2SO4溶液的体积是____? mL。?
(2)步骤②中反应的离子方程式为14H++Cr2O72-+6Fe2+==2Cr3++6Fe3++7H2O此反应中氧化剂和还原剂物质的量之比为?。?
(3) 处理1L该废水样液至少需要绿矾?__? g。
参考答案:(1)10?
(2)1:6?
(3)1.25
本题解析:
本题难度:一般
4、简答题 标准状况下,将224L的HCl气体溶于815mL水中?(ρ=1.00g/cm?3),所得盐酸的密度是1.18g/cm3.
(1)取该盐酸10.0mL,稀释至250.0mL,所得稀盐酸的物质的量浓度?
(2)若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,(忽略混合时溶液体积变化),求混合后溶液中H+物质的量浓度?
参考答案:n(HCl)=224L22.4L/mol=10mol,
所得溶液的质量为:10mol×36.5g/mol+815ml×1.00g/ml=1180g,
所得溶液的体积为:1180g1.18g/ml=1000ml,即1L,
则所得盐酸的物质的量浓度为:10mol1L=10mol/L
(1)设所得稀盐酸的物质的量浓度为c,
则有:0.01L×10mol/L=0.25L×c
解之得:c=0.4mol/L,
答:所得稀盐酸的物质的量浓度为0.4mol/L.
(2)密度为1.14g/cm3质量分数为20%的硫酸的物质的量为:n=430ml×1.14g/ml×20%98g/mol=1mol,
若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,
混合后的n(H+)=10mol+2mol=12mol
溶液的体积为:1L+0.43L=1.43L,
c(H+)=12mol1.13L=8.4mol/L.
答:混合后溶液中H+物质的量浓度为8.4mol/L.
本题解析:
本题难度:一般
5、简答题 配制500mL0.5mol/LNaOH溶液,试回答下列问题:
(1)需要称取NaOH固体的质量为______;
(2)配制方法:设计五个操作步骤,请在横线上填上合适的仪器名称
①向盛有NaOH的烧杯中加入100mL蒸馏水使其溶解,并冷却至室温.
②将NaOH溶液沿______注入______中.
③在烧杯中加入少量的蒸馏水,小心洗涤______2~3次并把每次的洗涤液都转移入______
④继续往______中加蒸馏水至液面接近刻度线1~2cm.
⑤改用______滴加蒸馏水至刻度线,盖好摇匀.
(3)以下操作会使实际配制NaOH溶液的浓度偏低的有______
A.定容时俯视刻度线B.溶解后的烧杯未经洗涤
C.称量用的烧杯不干燥D.容量瓶中原来存有少量蒸馏水.
参考答案:(1)需要氢氧化钠的物质的量是:0.5mol/L×0.5L=0.25mol,氢氧化钠的质量为:40g/mol×0.25mol=10g,
故答案是:10g;
(2)②将NaOH溶液沿着玻璃棒引流到500mL容量瓶中,
故答案是:玻璃棒;500mL容量瓶;
③转移完烧杯中溶解的溶液后,必须对烧杯和玻璃棒减小洗涤,洗涤后的溶液也要转移到容量瓶中,
故答案是:烧杯和玻璃棒;容量瓶;
④再继续向容量瓶中加蒸馏水,至液面接近刻度线1~2cm,
故答案是:容量瓶;
⑤定容时用胶头滴管定容,
故答案是:胶头滴管;
(3)A、定容时俯视刻度线,会导致配制的溶液的体积偏小,浓度偏高,故A错误;
B、溶解后的烧杯未经洗涤,导致配制的溶液中溶质的物质的量偏小,浓度偏小,故B正确;
C、称量氢氧化钠利用的是总质量和小烧杯的质量差,所以称量用的烧杯不干燥,不影响结果,故C错误;
D、容量瓶中有水,不影响配制结果,故D错误;
故选B.
本题解析:
本题难度:一般