时间:2025-06-25 23:18:56
1、选择题 若已发现了116号元素则下列推断正确的是
[? ]
①其钠盐的化学式为Na2R
②其最高价氧化物对应的水化物的酸性比硫酸强
③R是金属元素
④R是非金属元素
⑤最外电子层有6个电子
A.①②③
B.①③⑤
C.②④⑤
D.③⑤
参考答案:B
本题解析:
本题难度:一般
2、填空题 已知A、B、C、D、E、X存在下图示转化关系(部分生成物和反应条件略)。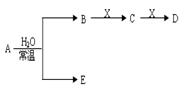
(1)若E为,则A与水反应的化学方程式?。表示X溶液呈碱性的离子方程式为?,用结构式表示C分子:?。
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为?。
(2)若E为常见单质气体,D为白色胶状沉淀,A的化学式可能是?,B中含有的化学键类型为?,C与X反应的离子方程式为?。
(3)若A、B均为气体单质,D可与水蒸气在一定条件下发生可逆反应生成C和一种可燃性气体单质,则该可逆反应的化学方程式为?。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的化学平衡常数K=1,则D的转化率为?。
参考答案:(1)3NO2 +H2O=2HNO3 + NO (2分)
①CO32-+H2O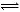 HCO3-+OH-(2分)? O="C=O" (1分)
HCO3-+OH-(2分)? O="C=O" (1分)
②Fe + 4H+ +NO3-= Fe3+ + NO↑+2H2O? (2分)
(2)Na (或Na2O2) (1分);?离子键和极性共价键(1分);Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)
(3)CO(g)+H2O(g)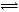 CO2(g)+H2(g) (2分)? 50% (1分)
CO2(g)+H2(g) (2分)? 50% (1分)
本题解析:(1)E为非金属氧化物,A一定含非金属元素,常温与水反应,有NO2,代入验证,X是Fe,成立。①当X是碱性溶液,C分子一定是酸性物质中,有22个电子,为CO2,X是碳酸盐,CO32-+H2O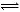 HCO3-+OH-显碱性。②当X为金属单质,即变价Fe时,则Fe与HNO3的稀溶液反应产生NO,Fe + 4H+ +NO3-= Fe3+ + NO↑+2H2O。
HCO3-+OH-显碱性。②当X为金属单质,即变价Fe时,则Fe与HNO3的稀溶液反应产生NO,Fe + 4H+ +NO3-= Fe3+ + NO↑+2H2O。
(2)D为白色胶状沉淀,联想到Al(OH)3,OH-来自于碱性溶液,若E为常见单质气体,故A是Na或Na2O2,B是NaOH,X为Al3+,C是AlO2-,C与X反应Al3++3AlO2-+6H2O=4Al(OH)3↓。
(3)D可与水蒸气在一定条件下发生可逆反应生成C和一种可燃性气体单质(水生成的一定是H2或O2中的一种,选择H2),D是CO,C是CO2,反应为CO(g)+H2O(g)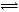 CO2(g)+H2(g),反应计量数均为1,K=
CO2(g)+H2(g),反应计量数均为1,K=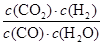 =1,说明平衡时c(CO)=c(CO2),CO的转化率为050%。
=1,说明平衡时c(CO)=c(CO2),CO的转化率为050%。
本题难度:一般
3、简答题 有①
参考答案:同位素指同一元素的不同原子,同分异构体指同一元素的不同单质;水分子是由1个氧原子和2个氢原子构成,从氢的三种同位素中选两个氢原子,两个氢原子可以相同也可不同,所以相对分子质量的和分别为2、3、4、5、6;氧原子相对分子质量分别为16、17、18,所以相对分子质量的种类数为7,故答案为:①④;③;7.
本题解析:
本题难度:一般
4、选择题 溴化碘(IBr)的化学性质类似卤素单质,它与水反应的化学方程式为 IBr + H2O = HBr + HIO 下列关于IBr有关性质的叙述中,正确的是
[ ? ]
参考答案:C
本题解析:
本题难度:一般
5、填空题 化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)“三酸”与“两碱”之间均可反应,酸过量时, 若用化学方程式表示有六个,若用离子方程式表示却只有两个,一个是H++OH-=H2O,请写出另一个离子方程式:?。
(2) 实验室制备H2、CO2、NH3、SO2时,用盐酸和稀硫酸可制备的相同气体是_______。
(3)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
①?;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,再将溶液蒸干,最终得到固体的质量为?g。
(5)利用侯德榜制碱法可制两碱的一种,请写出制取小苏打时在溶液中发生反应的总化学方程式?。
参考答案:(1)CO32-+2H+=H2O+CO2↑?(2分)
(2)H2(2分)
(3)Na2CO3和NaOH?(2分)
(4)5.85g (2分)
(5)H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl?(2分)
本题解析:(1)碳酸钠因其水溶液显现碱性而俗称纯碱。在物质的分类上属于盐。酸都电离产生氢离子H+,氢氧化钠电离产生OH-, Na2CO3电离产生CO32-,故发生上述两个离子反应,除了H++OH-=H2O,肯定有纯碱Na2CO3,写离子方程式应该是CO32-+2H+=H2O+CO2↑。
(2) 实验室制备H2用盐酸和稀硫酸可制备、实验室制备CO2只能用盐酸和碳酸钙制备,不能用稀硫酸、NH3实验室制备用氯化铵和氢氧化钙固体、SO2实验室制备用Na2SO3和浓硫酸,综上所述,相同气体是氢气。
(3)在NaOH溶液中通人一定量的CO2后,溶液中的溶质的组成分析:用数轴表示为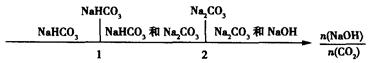
当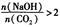 时,溶质的组成为NaOH和Na2CO3;当
时,溶质的组成为NaOH和Na2CO3;当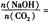 2时,溶质的组成为Na2CO3;当
2时,溶质的组成为Na2CO3;当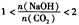 时,溶质的组成为Na2CO3和NaHCO3;当
时,溶质的组成为Na2CO3和NaHCO3;当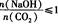 时,溶质的组成为NaHCO3。
时,溶质的组成为NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,说明全部转变成了氯化钠,氯化钠和氢氧化钠的物质的量相等,0.1 mol 氯化钠的质量为5.85gg。
(5)侯氏制碱法原理,是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。要制纯碱,先制得溶解度较小的NaHCO3。再利用碳酸氢钠不稳定性分解得到纯碱。要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子,铵根离子,氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。反应方程式为H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl。
本题难度:一般