时间:2025-06-25 23:18:06
1、填空题 (15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)  ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)  ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l)  ?H2O(l)+H2NCONH2(l)?△H2
?H2O(l)+H2NCONH2(l)?△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
参考答案:15分)⑴B?
⑵①2? 55?②0.148 mol/(L·min)? ③>
(每空3分,共15分)
本题解析:(1)由方程式2NH3(l)+CO2(g)  ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
(2)①合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)  ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l)  ?H2O(l)+H2NCONH2(l)?△H2;
?H2O(l)+H2NCONH2(l)?△H2;
从图形分析,第一步反应达平衡时时间更短,第二步反应达平衡时间更长,所以,合成尿素总反应的快慢由第二步决定;总反应进行到55min时到达平衡。
②v(CO2)=0.148 mol/(L·min);
③由图II可得,△H2>0;
本题难度:一般
2、填空题 (1)铝土矿的主要成分是Al2O3·3H2O,假设杂质是Fe2O3,写出由铝土矿制备金属铝的各步骤的化学方程式。(2013年高考题片段,源于高一教材)
(2)炼铁的原料有赤铁矿(假设杂质为SiO2)、焦炭、石灰石,设备为高炉,写出炼铁时所发生的主要的化学反应方程式?
(3)工业上用石英砂先煅烧制取粗硅,最后经过还原反应制取高纯硅,其反应方程式分别为:?
(4)假设没有Fe,生活会?
假设没有Al,生活会??
假设没有Si,生活会?
参考答案:(27分)方程式各2分,(4)问共3分
(1)①Al2O3+2NaOH=2NaAlO2+H2O?②NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
③2Al(OH)3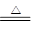 Al2O3+3H2O?④2Al2O3
Al2O3+3H2O?④2Al2O3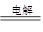 4Al+3 O2↑
4Al+3 O2↑
(2)①C+O2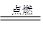 CO2?②CO2+C
CO2?②CO2+C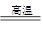 2CO?③Fe2O3+3CO
2CO?③Fe2O3+3CO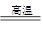 2Fe+3CO2
2Fe+3CO2
④CaCO3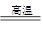 CaO+CO2↑?⑤CaO+SiO2
CaO+CO2↑?⑤CaO+SiO2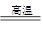 CaSiO3
CaSiO3
(3)①SiO2+2C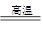 Si(粗硅)+2CO↑?②Si+2Cl2
Si(粗硅)+2CO↑?②Si+2Cl2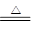 SiCl4
SiCl4
③SiCl4+2H2===Si(高纯硅)+4HCl
(4)合理答案都给分。没有Fe,过原始人的生活,没有Al,过封建社会生活,没有Si,没法过信息时代的生活。
本题解析:(1)铝土矿的主要成分是Al2O3·3H2O,杂质是Fe2O3,则提纯氧化铝时必须除去氧化铁。根据氧化铝两性氧化物可知,姜铝土矿溶解在氢氧化钠溶液中,氧化铝溶解,生成偏铝酸钠,过滤得到偏铝酸钠溶液。向偏铝酸钠中通入CO2即生成氢氧化铝沉淀,过滤即得到氢氧化铝。氢氧化铝分解生成氧化铝,电解氧化铝即得到金属铝。
(2)高炉炼铁时焦炭燃烧生成CO2,高温下碳和CO2反应又生成CO。生成的CO具有还原性,在高温下可以还原氧化铁。在高温下石灰石分解生成氧化钙和CO2,生成的氧化钙在高温下在和二氧化硅反应生成硅酸钙。
(3)石英砂的主要成分是二氧化硅,在高温下和二氧化硅反应生成粗硅。粗归和氯气在高温下反应生成四氯化硅,然后利用氢气还原四氯化硅置换出单质硅。
点评:该题是基础性试题的考查,试题基础性强,紧扣教材基础知识,有利于调动学生的学习兴趣,激发学生的学习积极性。也有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
3、填空题 技术的发展与创新永无止境,我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图:
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式),原因是________________。
(2)沉淀池中发生的化学反应方程式是________________。
(3)母液中的溶质主要是________。向母液中通氨气后再加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是________,从沉淀池中提取沉淀的操作是________________。
(5)写出煅烧炉中发生反应的化学方程式____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是________(填化学式),为检验该杂质的存在,具体操作是__________________________________。
参考答案:(1)NH3 因为CO2溶解度较小,而NH3易溶于水,先通NH3有利于CO2吸收
(2)NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
(3)NH4Cl 增大NH4+浓度,使NH4Cl更多析出
(4)循环Ⅰ CO2 过滤
(5)2NaHCO3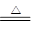 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(6)NaCl 取少量试样溶解,加用HNO3酸化的AgNO3溶液,若有白色沉淀,说明含有NaCl杂质
本题解析:向沉淀池中通入氨气,使溶液显碱性,有利于CO2吸收;母液中的溶质主要是副产品NH4Cl,通氨气及加入细小食盐颗粒都可使NH4Cl的溶解平衡向结晶方向移动;采取循环操作可提高原料的利用率;由于用了饱和食盐水使析出的碳酸氢钠含氯化钠,则纯碱中含氯化钠。
本题难度:一般
4、实验题 二氧化铈 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
(1)洗涤滤渣A的目的是为了去除?(填离子符号),检验该离子是否洗净的方法是?。
(2)第②步反应的离子方程式是?,滤渣B的主要成分是?。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP?(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有?、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol? 溶液(铈被还原为
溶液(铈被还原为 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中 的质量分数为?。
的质量分数为?。
参考答案:(1) Fe3+?;取少量最后一次洗涤液于试管中,滴加2-3滴KSCN,如果不出现红色,则洗涤干净。(2)2CeO2+H2O2+6H+ =" 2" Ce3+ +O2↑+ 4H2O?;SiO2(3)不能;分液漏斗(4)97.01%
本题解析:(1)洗涤滤渣A的目的是为了去除 Fe3+ ,检验该离子是否洗净的方法是取少量最后一次洗涤液于试管中,滴加2-3滴KSCN,如果不出现红色,则洗涤干净;(2)第②步反应为二氧化铈氧化过氧化氢的反应,所以其离子反应方程式为:2CeO2+H2O2+6H+ =" 2" Ce3+ +O2↑+ 4H2O,由于二氧化硅不与酸反应,所以滤渣B的主要成分是二氧化硅,(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,根据萃取的条件可以知道,TBP不与水互溶;实验室进行萃取操作是用到的主要玻璃仪器有分液漏斗、烧杯、玻璃棒、量筒等;(4)用0.1000mol? 溶液(铈被还原为
溶液(铈被还原为 ),消耗25.00mL溶液,所以铈质量为=0.1000×0.025×140g=0.35g,所以
),消耗25.00mL溶液,所以铈质量为=0.1000×0.025×140g=0.35g,所以 的质量为0.35g×208/140=0.52g,故
的质量为0.35g×208/140=0.52g,故 的质量分数=0.52/0.536×100%=97.01%。
的质量分数=0.52/0.536×100%=97.01%。
点评:本题考查了元素及其化合物,该考点是高考考查的重点,本题由一定的综合性,该题有利于培养学生的分析能力,该题难度不大。
本题难度:困难
5、选择题 下列有关复合材料的说法中,正确是的
[? ]
A.复合材料就是两种材料未经处理掺杂在一起来使用的材料
B.玻璃钢是目前合成的唯一一种复合材料
C.合成复合材料时不仅可以选择不同的组分材料,而且可以通过以身改变各种组分材料的含量来满足不同的需要
D.复合材料的研究已过一定程度,从应用来看没有广阔的前景
参考答案:C
本题解析:
本题难度:简单