时间:2025-06-25 23:17:20
1、选择题 在2 L密闭容器中发生反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的物质的量减少0.6 mol,下列对该反应速率表示正确的是
A.在2 min末的反应速率:v (B)=0.3 mol·L-1·min-1
B.用A表示的反应速率为:v (A)=0.4 mol·L-1·min-1
C.用D表示的平均反应速率为:v (D)= 0.05 mol·L-1·min-1
D.分别用B、C表示的反应速率其比值为2∶3
参考答案:C
本题解析:A、2min,B的物质的量减少0.6mol,则减少的B的物质的量浓度=0.6mol÷2L=0.3mol/L,所以用B物质表示的反应速率v(B)=0.3mol/L÷2min=0.15mol?L-1?min-1,A不正确;B、由于A物质为纯固体,则不能利用纯固体表示反应速率,故B错误;C、因为反应速率之比等于化学计量数之比,所以根据反应方程式可知用D表示的平均反应速率为v(D)=0.15mol?L-1?min-1×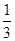 =0.05 mol?L-1?min-1,故C正确;D.反应速率之比等于化学计量数之比,则分别用B、C表示的反应速率其比值为3:2,所以D错误,答案选C。
=0.05 mol?L-1?min-1,故C正确;D.反应速率之比等于化学计量数之比,则分别用B、C表示的反应速率其比值为3:2,所以D错误,答案选C。
考点:考查反应速率的计算
本题难度:一般
2、实验题 (12分)某同学为了探究锌与硫酸反应过程中的速率变化,他在100mL稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
参考答案:(1) 2~3min(1分),温度对反应速率影响占主导作用(1分)。
(2) 4~5min(1分),浓度对反应速率影响占主导作用(1分)。
(3) 2~3min产生的V(H2)=" 232" mL -120mL="112" mL=0.112L
n(H2)=? =0.005mol
H2SO4? ~? H2↑
1? 1?
n(H2SO4)? 0.005mol
所以n(H2SO4) =0.005mol
因此硫酸的反应速率为 ="0.05" mol/(L?min)(2分)
="0.05" mol/(L?min)(2分)
(4)①Zn+Cu2+=Zn2++Cu(1分);Zn+2H+=Zn2++H2↑(1分)
②? CuSO4与Zn反应产生的Cu与Zn形成原电池加快了氢气产生的速率。(1分);
③? Ag2SO4(1分);
④加入一定量的 CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积(2分)。
本题解析:(1)根据表中数据可知,在0~1、1~2、2~3、3~4、4~5min内收集到的氢气分别是(ml)50、70、112、58、20。所以2~3min内反应速率最大,这是由于反应是放热反应,温度对反应速率的影响超过了浓度对反应速率的影响。
(2)4~5min内收集到的气体最少,所以反应速率最小。这是由于随着反应的进行,反应物
的浓度减小,此时浓度对反应速率的影响超过了温度对反应速率的影响。
(3)略
(4)加入硫酸铜后,新可以置换出铜,从而构成铜锌原电池,锌作负极,加快反应速率。有
关离子方程式为Zn+Cu2+=Zn2++Cu(、Zn+2H+=Zn2++H2↑。由于银的金属性也弱于锌的,所
以也能和锌构成原电池,因此与硫酸铜相似的是硫酸银。如果硫酸铜太多,则生成的单质Cu
会沉积在Zn的表面,降低了Zn与溶液的接触面积,从而降低反应速率。
本题难度:一般
3、实验题 (12分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
参考答案:(1)H2C2O4(草酸)溶液的浓度 ① ②
(2)②反应放出的热量使环境温度升高,加速反应,(或其他合理答案)
(3)5.2×10-3 5×10-4 mol·L-1·min-1(4)产生相同体积的CO2所需的时间
本题解析:(1)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,答案为:浓度,①<②;
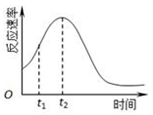
(2)该反应为放热反应,随着反应的进行,温度升高,t1~t2时间内化学反应速率变快;
(3)CO2的物质的量是: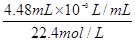 =0.0002mol,设4min末,反应c(MnO4-)为X
=0.0002mol,设4min末,反应c(MnO4-)为X
2 MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
X 0.0002mol
解得X=0.00004mol
30mL×10-3×0.01mol/L—0.00004mol=0.00026mol
c(MnO4-)=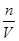 =
=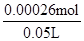 =0.0052mol/L=5.2×10-3 mol/L;
=0.0052mol/L=5.2×10-3 mol/L;
v(H2C2O4)=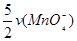 =
=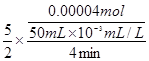 = 5×10-4 mol·L-1·min-1
= 5×10-4 mol·L-1·min-1
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率。
考点:考查化学反应速率影响因素的探究。
本题难度:困难
4、选择题 下列说法正确的是?(?)
A.决定化学反应速率的主要因素是参加反应的物质的性质
B.催化剂可以使不起反应的物质发生反应
C.可以找到一种催化剂使水变成油(油的成份为碳氢化合物的混合物)
D.催化剂是决定化学反应速率的主要因素
参考答案:A
本题解析:BC、催化剂知识能影响化学反应速率,不能决定化学反应的进行,故错;
D、决定化学反应速率的因素是物质本身的性质,故错。
故选A。
点评:本题考查影响化学反应速率的因素,要注意与外因(浓度、温度、压强、催化剂)的区别,压强影响速率实质为影响浓度。
本题难度:一般
5、简答题 氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n?mol?N2、3n?mol?H2,经过t?min后反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为______;t?min内用NH3表示的速率是______mol/L.min
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)
2NH3(g)+92.2kJ/mol
(表示当生成2mol?NH3时放出92.2KJ的热).有关键能:N≡N:945.6kJ/mol;N-H:391.0kJ/mol,则H-H键能为______KJ/mol.
参考答案:(1)、N2(g)+3H2(g)
2NH3(g) 物质的量减少△n
? 1mol? 3mol?2mol? 2mol
? namol? 3namol?2namol? 2namol
达平衡后,反应混合物的总的物质的量为nmol-namol+3nmol-3namol+2namol=2n(2-a)mol,
压强之比等于物质的量之比,所以容器内气体的压强反应前与平衡时的比值为nmol+3nmol2n(2-a)mol=22-a;
t?min内,用NH3表示的速率v(NH3)=2namolVLtmin=2an/(V?t)mol/(L.min).
故答案为:22-a;?2an/(V?t)mol/(L.min).
(2)反应热等于反应物的总键能减去生成物的总键能,令H-H键能为 xKJ/mol,则
945.6kJ/mol+3xKJ/mol-6×391.0kJ/mol=-92.2kJ/mol
解得,x=436.1
故答案为:436.1kJ/mol
本题解析:
本题难度:一般